П элементы 6 группы. Элементы VI А группы
Кислород в своих соединениях проявляет, как правило, валентность равную двум. Но в принципе он может быть и четырех валентен, так как на внешнем слое кислород имеет 2 неспаренных электрона и 2 неподеленные электронные пары. Но поскольку атом кислорода имеет маленькой размер, то максимальная валентность кислорода равна трем, так как вокруг него может разместиться только три атома водорода.
Файлы: 1 файл
Общая характеристика элементов VI A подгруппы
К главной подгруппе VI группы периодической системы относятся кислород, сера, селен, теллур и полоний. Неметаллические свойства у элементов VI-А группы выражены менее ярко, чем у галогенов. Валентными уних являются электроны ns2 np4
Так как атомы элементов VI-А группы содержат на внешнем слое шесть электронов, то они стремятся к заполнению электронами внешнего энергетического уровня и для них характерно образование анионов Э2-.К образованию катионов атомы рассматриваемых элементов (кроме полония) несклонны. Кислород и сера – типичные неметаллы, причем кислород относится к самым электроотрицательным элементам (на втором месте после фтора). Полоний – металл серебристо-белого цвета, напоминающий по физическим свойствам свинец, а по электрохимическим свойствам – благородные металлы. Селен и теллур занимают промежуточное положение между металлами и неметаллами, они являются полупроводниками. По химическим свойствам они стоят ближе к неметаллам. Кислород, серу, селен и теллур объединяют в группу "халькогенов", что в переводе с греческого языка означает "порождающие руды". Эти элементы входят в состав многочисленных руд. От кислорода к теллуру содержание элементов на Земле резко падает. Полоний не имеет стабильных изотопов и встречается в урановых и ториевых рудах, как один из продуктов распада радиоактивного урана.
По своим свойствам кислород и сера резко отличаются друг от друга, т.к. электронные оболочки предыдущего энергетического уровня построены у них различно. Теллур и полоний имеют одинаковое строение внешнего энергетического уровня (валентного слоя) и предпоследнего энергетического уровня, поэтому они в большей степени схожи по своим свойствам.
Кислород в своих соединениях проявляет, как правило, валентность равную двум. Но в принципе он может быть и четырех валентен, так как на внешнем слое кислород имеет 2 неспаренных электрона и 2 неподеленные электронные пары. Но поскольку атом кислорода имеет маленькой размер, то максимальная валентность кислорода равна трем, так как вокруг него может разместиться только три атома водорода.
Кислород и его соединения
Свойства кислорода. Кислород О2 – газ без цвета, запаха и вкуса. Плохо растворим в воде: при 20оС в 100 объемах воды растворяется около 3 объемов кислорода. Жидкий кислород имеет светло-голубой цвет, он притягивается магнитом, так как его молекулы парамагнитны, имеют два неспаренных электрона. Энергия связи в молекуле О2 равна 493 кДж/моль, длина связи 0,1207 нм, порядок связи в молекуле равен двум. В природе кислород существует в виде трех изотопов16О, 17О, 18О и в виде двух аллотропных модификаций кислорода О2 и озона О3. В воздухе кислорода в свободном состоянии содержится около 21%.
Получение кислорода. В лаборатории кислород получают разложением соединений, богатых кислородом: а) 2 KClO3 = 2 KCl + 3 O2 (катализатор – MnO2) б) 2 KMnO4 = O2 + K2MnO4 + MnO2 в) Н2О2 = 2 Н2О + О2 (катализатор – MnO2) г) электролизом водных растворов кислородсодержащих кислот и щелочей с инертным анодом. В промышленности кислород получают разделением жидкого воздуха в ректификационных колоннах.
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Термодинамика – наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально обнаруженных объективных закономерностях, выраженных в двух основных началах термодинамики.
Термодинамика изучает:
1. Переходы энергии из одной формы в другую, от одной части системы к другой;
2. Энергетические эффекты, сопровождающие различные физические и химические процессы и зависимость их от условий протекания данных процессов;
3. Возможность, направление и пределы самопроизвольного протекания процессов в рассматриваемых условиях.
Необходимо отметить, что классическая термодинамика имеет следующие ограничения:
1. Термодинамика не рассматривает внутреннее строение тел и механизм протекающих в них процессов;
2. Классическая термодинамика изучает только макроскопические системы;
3. В термодинамике отсутствует понятие "время".
ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ
Термодинамическая система – тело или группа тел, находящихся во взаимодействии, мысленно или реально обособленные от окружающей среды.
Гомогенная система – система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы).
Гетерогенная система – система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы.
Фаза – совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделённая от других частей системы видимыми поверхностями раздела.
Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – система, которая обменивается с окружающей средой энергией, но не обменивается веществом.
Открытая система – система, которая обменивается с окружающей средой и веществом, и энергией.
Компонентами системы называются индивидуальные вещества, которые, будучи взяты в наименьшем количестве, достаточны для описания (образования) всех фаз системы. выделение компонентов обусловлено конкретным содержанием системы и зависит от тех химических реакций, которые протекают внутри системы и при ее взаимодействии с внешней средой.В сложных минеральных системах в качестве компонентов обычно выступают окислы или элементы.
Параметрами называются величины, при помощи которых может быть описано состояние системы. Фундаментальные параметры систем: температура (Т), энтропия (S), давление (р), объем (V), массы компонентов (m a ...m k) и их химические потенциалы (μ a ...μ k).
Экстенсивными называются парам етры, обладающие свойством аддитивности (слагаемости), т. е. экстенсивные параметры зависят от массы или числа частиц системы. К экстенсивным параметрам относятся объем, энтропия и массы компонентов. Экстенсивные параметры иногда называют параметрами емкости. Интенсивными параметрами, или параметрами напряженности, называются такие, которые не зависят от массы или числа частиц системы. К ним относятся температура, давление и химические потенциалы компонентов.
Существует примечательное свойство термодинамических параметров, которое можно назвать свойством симметричности и сопряженности. Свойство симметричности состоит в том, что любой термодинамический процесс в системе характеризуется парой параметров, один из которых интенсивный, другой - экстенсивный.
Первое начало термодинамики представляет собой закон сохранения энергии, один из всеобщих законов природы:Энергия неуничтожаема и несотворяема; она может только переходить из одной формы в другую в эквивалентных соотношениях.
Первое начало термодинамики представляет собой постулат
Полная энергия изолированной системы постоянна;
Невозможен вечный двигатель первого рода (двигатель, совершающий работу без затраты энергии).
Первое начало термодинамики устанавливает соотношение между теплотой Q, работой А и изменением внутренней энергии системы ΔU: Уравнение 1является математической записью 1-го начала термодинамики для конечного, уравнение 2 – для бесконечно малого изменения состояния системы.
Внутренняя энергия является функцией состояния; это означает, что изменение внутренней энергии ΔU не зависит от пути перехода системы из состояния 1 в состояние 2 и равно разности величин внутренней энергии U 2 и U 1 в этих состояниях:
Изохорическийй процесс (V = const; ΔV = 0).поглощение или выделение тепла связано только с выделением Е
Изотермический процесс (Т = const).это процесс квазистатического расширения или сжатия вещества, находящегося в контакте с тепловым резервуаром.
Изобарический процесс (Р = const).
Адиабатический процесс (Q = 0).Это процесс квазистатического расширения или сжатия газа в сосуде с теплонепроницаемыми оттенками. А=- U
ВНУТРЕННЯЯ ЭНЕРГИЯ термодинамич. ф-ция состояния системы, ее энергия, определяемая внутр. состоянием. Внутренняя энергия складывается в осн. из кинетич. энергии движения частиц (атомов, молекул, ионов, элект ронов) и энергии взаимод. между ними (внутри- и межмолекулярной).
При изотермическом процессевнутренняя энергия идеального газа не меняется. Все переданное газу количество теплоты идет на совершение работы:Q = A
Изменение внутренней энергии при изобарном процессе:ΔU=3/2 ·v·R·ΔT.
изменение внутренней энергии при адиабатном:Q=m·C p D·T/m.
Энтальпия-величина, пропорциональна кол-ву в-ва и измеряется в [КДж/моль] Н<0-экзотермический, Н>0 эндотермический.
При взаимодействии газообр. в-в образуется Н2О, которая может находится в различных состояниях.
Стандартное состояние энтальпий Т=298К, Р=101,325кПа
Кислород, сера, селен, теллур и полоний составляют главную подгруппу шестой группы периодической системы и являются р-элементами. Их атомы имеют на внешнем электронном уровне по шесть электронов и общую электронную конфигурацию внешнего электронного слоя можно выразить формулой: ns2np4. Электронные формулы атомов и некоторые физические константы приведены в таблице.
электронная конфигурация атома | средняя атомная масса | кажущийся радиус нейтрального атома, А | сродство к электрону, эВ | относительная электро отрицательность | кажущийся радиус иона | |||
Из данных таблицы следуют такие выводы:
1. Кажущиеся радиусы нейтральных атомов и отрицательных ионов правильно растут с увеличением порядкового номера элемента.
2. Величина относительной электроотрицательности уменьшается с увеличением кажущихся радиусов нейтральных атомов. Следовательно, от кислорода к полонию ослабевают окислительные свойства и увеличиваются восстановительные свойства нейтральных атомов. Сильнейшим окислителем среди этих элементов является кислород:
O – S – Se – Te – Po
Усиление окислительных свойств
3. С увеличением порядковых номеров элементов наблюдается постепенное ослабление неметаллических свойств и усиление металлических свойств.
Распределение валентных электронов у р-элементов шестой группы по атомным орбиталям имеет следующий вид:
для кислорода
для серы, селена, теллура и полония
Наличие шести электронов на внешнем квантовом слое характеризует способность рассматриваемых элементов проявлять отрицательную степень окисления 2–. Все элементы способны образовывать отрицательно заряженные ионы с зарядом 2–. Склонность к образованию отрицательно заряженных ионов Э-2 ослабевает от кислорода к полонию.
У атома кислорода отсутствует d-подуровень. Поэтому, вследствие наличия у него двух неспаренных p-электронов, атом кислорода может образовать с атомами других элементов две химические связи. Отсюда ясно, что соединения, образованные кислородом с одновалентными элементами, имеют формулу Э2О. Кроме того, атом кислорода может образовывать связь по донорно-акцепторному механизму.
Атом кислорода может выступать как донор – за счет имеющейся у него не поделенной пары электронов, например, при образовании иона гидроксония (Н2О + Н+= Н3О+) и как акцептор – за счет свободной орбитали, появляющейся у него при возбуждении путем спаривания двух неспаренных электронов (что наблюдается, например, в молекуле азотной кислоты // О
Н – О – N.
В зависимости от природы того атома, с которым кислород вступает во взаимодействие, степень его окисления может быть различной:
2(Н2О); -1(Н2О2); 0(О2); +1(O2F2); +2(ОF2).
У атомов серы, селена, теллура и полония имеется свободный d-подуровень. При возбуждении этих атомов их электроны могут переходить на вакантные d-орбитали и поэтому эти элементы проявляют следующие степени окисления: -2, +2, +4, +6.
Простые вещества.
Особенностью этой группы является полиатомность молекул простых веществ Эn, где 2 ≤ n ≤ ∞.
кислород | |||||
состав молекул | S8 (комн. tº) | Se8; Se∞ (комн. tº) | Te∞(комн. tº) Te2(>1400ºC) | ||
аллотропические модификации | О2(кислород) | ромбическая (ниже 95,6ºC) моноклинная (выше 95,6ºC) аморфная (пластическая) | красный (кристаллический металлический (серый) аморфный | металлический аморфный | α - модифицир-ый β- модифицир-ый |
ρ, плотность г/см3 | 4,82 (металл.) | 6,25 (металл.) | |||
t плавления ºC | |||||
t кипения ºC | |||||
распространенность элемента | Кларк - 49% Литосфера-47,3% воздух -23,1% |
Из данных, приведенных в таблице, можно сделать следующие выводы:
1. Молекулы простых веществ, образуемые атомами p-элементами VI группы, полиатомны.
2. Для всех элементов характерно наличие аллотропических модификаций.
3. Температуры кипения и плавления (кроме полония), плотности их с увеличением порядкового номера возрастают.
Сера была известна до 5000 лет до н. э.
Кислород был открыт четыре раза: в 1772 г. Шееле (HgO), в1774 г. Пьер Байен, Пристли (Pb3O4 прокаливал – получил PbO и О2), Лавуазье дал название кислороду и определил, что он входит в состав воздуха.
Теллур (земля) – 1798 г. Клапрот.
Селен (луна) – 1817 г. Берцелиус нашел в шламе
Полоний – 1898 г. открыт Марии Кюри – Складовской и назван в честь ее родины (Польша).
Кислород
Кислород – самый распространенный элемент на Земле (58,0 мол. доли). Его большая химическая активность и количественное преобладание в значительной мере предопределяет формы существования всех других элементов на Земле. Самым распространенным природными соединениями кислорода являются Н2О, SiO2, силикаты и алюмосиликаты. В воздухе кислород находится в свободном состоянии и на его долю приходится 20,99% (об.). В верхних слоях атмосферы кислород находится в виде газа – озона (О3). Озоновый слой задерживает жесткое солнечное излучение, которое, при длительном воздействии на живые организмы, является для них смертельным.
Природный кислород состоит из трех стабильных изотопов: 16О(99,795%), 17О(0,037%) и 18О (0,204%). Кроме того, получены три радиоактивных изотопа, время жизни которых ничтожно мало.
По значению относительной электроотрицательности (ОЭО = 3,5) кислород уступает только фтору. Кислород образует соединения почти со всеми элементами, исключая гелий, неон и аргон. В соединениях с другими элементами, кроме уже упомянутых степеней окисления (-2, -1, +1, +2), кислород проявляет степень окисления +4 в озоне.
Для кислорода известны две аллотропических модификации: 1) О2 – кислород; 2) О3 – озон.
Наиболее устойчива двухатомная молекула кислорода (О2). Порядок связи в данной молекуле равен 2. Из энергетической диаграммы следует, что кислород является веществом парамагнитным (в молекуле имеется два неспаренных электрона). Это положение полностью подтверждает опыт. Энергия диссоциации молекулы О2 равна 494 кДж/моль, что указывает на достаточную ее устойчивость. Химическая активность молекулы кислорода объясняется наличием неспаренных электронов на разрыхляющих π орбиталях. В обычных условиях О2 – бесцветный газ. Жидкий кислород имеет голубую окраску. Кристаллы твердого кислорода окрашены в светло-синий цвет и похожи на снег. Кислород несколько тяжелее воздуха (dвоз = 1,105). В воде кислород растворяется в очень небольшом количестве. В каждом и твердом состоянии кислород притягивается магнитом.
Получение кислорода
В промышленности кислород получают из жидкого воздуха, электролизом воды, в качестве побочного продукта при получении водорода высокой чистоты.
В лаборатории кислород получают при термическом разложении богатых кислородом соединений (KМnO4, KСlO3, KNO3 и др.).
Например: 2КMn+7O4-2 tº→ К2Мn+6О4 + Mn+4О2 + О20
Такие реакции относятся к реакциям внутримолекулярного окисления-восстановления.
Химические свойства
По реакционной способности О2 уступает только галогенам. Химическая активность его растет с повышением температуры. О2 взаимодействует почти со всеми химическими элементами, за исключением галогенов, благородных газов и благородных металлов (серебро, золото, платина). Иногда взаимодействию препятствует оксидная пленка на поверхности окисляемого вещества.
Скорость реакций окисления зависит от природы окисляемого вещества, температуры, катализатора и т. д. Большинство реакций окисления экзотермичны, например
С + О2 → СО2 ΔΗ = -382,5 кДж/моль
2Н2 + О2 → 2Н2О ΔΗ = -571,7 кДж/моль
Применение кислорода
Основная масса кислорода, получаемого промышленностью, расходуется в черной металлургии для интенсификации выплавки чугуна и стали. Кислород широко используется в нефтехимическая
промышленность" href="/text/category/himicheskaya_i_neftehimicheskaya_promishlennostmz/" rel="bookmark">химической промышленности при получении серной и азотной кислот, смазочных масел и т. д. В смеси с ацетиленом О2 используется для сварки и резки металлов (температура пламени около 3200ºC). Жидкий кислород применяется в ракетах, горнорудном деле.
Озон
Озон (О3) является второй аллотропической модификацией кислорода. Это синий газ с резким запахом (т. кип. -112ºC, т. пл. -193ºC). Жидкий озон представляет собой темно-синюю жидкость. Твердый озон - черного цвета. Озон очень токсичен и взрывоопасен. Образование молекул озона сопровождается поглощением энергии:
https://pandia.ru/text/78/050/images/image014_50.gif" width="50" height="51 src=">О
https://pandia.ru/text/78/050/images/image017_44.gif" width="38" height="38"> 126 Ǻ 116,5º
Получают озон действием тихого электрического разряда на кислород. Небольшое количество озона образуются в процессах, сопровождающихся выделением атомарного кислорода (радиолиз воды, разложение пероксидов и т. д.). В естественных условиях озон образуется из атмосферного кислорода при грозовых разрядах и под действием ультрафиолетовых солнечных лучей. Максимальная концентрация озона образуется на высоте ≈ 25 км. «Озоновый пояс» играет важнейшую роль в обеспечении жизни на Земле, так как задерживает вредное для живых организмов ультрафиолетовое излучение и поглощает инфракрасное излучение Земли, препятствуя ее охлаждению.
Озон более активный окислитель, чем кислород. Например, уже при обычных условиях он окисляет многие металлы и другие вещества
2Ag + O3 → Ag2O + O2
PbS + 4O3 → PbSO4 + 4O2
В реакциях с его участием обычно образуется кислород. Со многими веществами озон реагирует в таких условиях, когда кислород остается инертным. Так, реакция О3 + 2KI + H2O = I2+2KOH+O2 протекает количественно и ее можно использовать для количественного определения озона.
Кроме того, известны реакции, в которых молекула озона участвует всеми тремя атомами кислорода, например KI + O3 → KIO3.
3SnCl2 + O3 + 6HCl = 3 SnCl4 + 3H2O.
Применение озона обусловлено его окислительными свойствами. Он используется в качестве дезинфицирующего и бактерицидного средства, для очистки воды, в пищевой промышленности и т. д.
Пероксиды
Пероксиды - это кислородные соединения, в которых атомы кислорода непосредственно связаны между собой. Таким образом, в структуре пероксидов имеется группировка –O–O–, её называют пероксид-ион .
Пероксид- и надпероксид-ионы получаются при соединении электронов к молекуле O2
O20+e → O2- - надпероксидый
O20+2e → 2O2- -пероксидный
O2-пара O2--пара O22-диа -
уменьшение устойчивости
Соединения, содержащие в своём составе надпероксид-ион (O2-), называются надпероксидами, например, KO2. Наличие у них неспаренного электрона обуславливает их парамагнетизм. В пероксид-ионе (O2-2) неспаренные электроны отсутствуют и поэтому этот ион диамагнитен. В пероксидах атомы кислорода связаны между собой одной двух электронной связью. Образование пероксидов характерно для активных металлов (щелочных, щелочно-земельных). Наиболее практическое значение имеет пероксид водорода (H2O2).
Молекула H2O2-полярна(μ=0,70∙10-29Кл∙м.) Наличие водородных связей обуславливает высокую вязкость пероксида водорода. Из-за ассоциации молекул H2O2 в обычных условиях представляет собой жидкость (tпл.=-0,410C, tкип.=1500C). Пероксид водорода легко разлагается на атомарный водород и кислород, H2O2=t H2+O2
растворим в воде, водный раствор H2O2–слабая кислота. Константа диссоциации Kg(H2O2)=2,24∙10-12
Получить пероксид водорода можно по общему способу получения слабых кислот (вытеснение слабой кислоты из её соли более сильной кислотой)
BaO2+H2SO4=H2O2+BaSO4↓
В промышленности пероксид водорода получают электрохимическим окислением серной кислоты при низкой температуре на платиновом аноде .
H 2 O 2 в ОВР
Кислороду в пероксиде водорода приписывают степень окисления, равную –1 (эта степень окисления является промежуточной для кислорода). Поэтому может быть как окислителем, так и восстановителем. При восстановлении H2O2 образуется вода или OH-, например
2KJ+H2O2+H2SO4=J2+K2SO4+2H2O
PbS+H2O2=PbSO4+H2O
2K3+3H2O2=2K2CrO4+2KOH+8H2O
В этих случаях идёт процесс: H2O2-окислитель
При взаимодействии с сильными окислителями пероксид водорода проявляет свойства восстановителя
5H2O2+2KMnO4+3H2SO4→5O20+2MnSO4+K2SO4+8H2O
Данная реакция используется в химическом анализе для количественного определения содержания пероксида водорода в растворе.
Применение:
3% раствор в медицине в качестве антисептика ,
6%-12% раствор – для обесцвечивания волос,
более 30% конц. в химической промышленности.
Сера
Общая характеристика серы. В отличие от кислорода, у серы имеются в наружном квантовом слое вакантные 3d-орбитали.
Сера может иметь следующие степени окисления:
2 (H2S, H2S2O3 и сульфиды, тиосульфат натрия Na2S2O3·5H2O, где один атом серы имеет степень окисления –2, а другой +6.;
2 (S2Cl2, 3SO→SO2+S2O)
4 (SO2, H2S+4O3, её соли);
6 (SO3, H2SO4, её соли, H2S2O7 пиросерная кислота)
H2SO5-пероксомоносерная кислота
H2S2O8-пероксодисерная кислота
Сера – типичный неметалл (оэо=2,5), она химически активна и непосредственно соединяется почти со всеми элементами, за исключением азота, йода, золота, платины, и благородных газов. В природе встречается как в свободном состоянии (самородная сера), так и в виде различных соединений.
Самородная сера встречается редко, наиболее распространены минералы сульфидных (FeS2, CuS, ZnS, Sb2S3, AgS) и сульфатных соединений (CaSO4·2H2O, BaSO4, MgSO4·7H2O, Na2SO4·10H2O), SO2, H2S – содержат вулканические газы. Кроме, того сера входит в состав растительных и животных белков и соединений, входящих в нефть. Во всех твердых и жидких состояниях сера диамагнитна.
Простые вещества
Сера существует в нескольких аллотропных модификациях. При комнатной температуре устойчива, желтая ромбическая сера (α-S), состоящая из очень мелких кристаллов. Большие кристаллы этой формы можно получить при медленной кристаллизации серы из раствора серы в сероуглероде. Они получаются правильно ограненные и прозрачные.
Вторая аллотропная модификация - это моноклинная сера (β-S)-кристаллы игольчатой формы.
Аллотропные модификации α- и β- серы состоят из молекул S8, которые имеют циклическое «зубчатое» строение.
У ромбической серы кольца находятся на расстоянии 3,3 Ǻ друг от друга. Они связаны между собой силами Ван-дер-Ваальса. Эта модификация не проводит тепло и электричество.
Различие в физических свойствах ромбической и моноклинной серы обусловлено не разным составом молекул (обе состоят из S8), а неодинаковой структурой кристаллов.
Существуют и другие аллотропные модификации серы, которые образуются при изменении температуры. Изменение давления тоже дает различные аллотропные формы.
С повышением температуры сера меняет свою окраску, так как идет уменьшение длины цепей:
600ºC 900ºC 1500ºC
оранжевый красный желтый
Самой устойчивой модификацией является ромбическая, в нее самопроизвольно переходят все остальные модификации.
Сера хорошо растворима в органических растворителях, особенно в сероуглероде и бензоле (34%, t = 25ºC).
Химические свойства серы
Сера – элемент весьма активный. При взаимодействии с более сильными окислителями (O2, CI2 и т. д.) она может отдавать свои электроны, то есть быть восстановителем:
S + Cl2 ↔ SCl2 (S2Br2, S2Cl2)
S0 - 4ē → S+4
2O0 + 4ē → 2O-2
P4 + xS ↔P4Sx x ~ 3, x~ 7
При оплавлении или нагревании сера взаимодействует почти со всеми металлами с образованием нестехиометрических соединений (проявляет свойства окислителя).
Hg0 + S0 = Hg+2S-2
С большинством металлов сера реагирует при нагревании, а со ртутью – при комнатной температуре. Поэтому серой засыпают разлитую ртуть с целью обеззараживания помещения от ртутных паров.
Сера также склонна к реакциям диспропорционирования . Например, при кипячении порошкообразной серы в растворе щелочи идет реакция
S0 + 2S0 +6NaOH = Na2+4SO3 + 2Na2S-2 + 3H2O
Сера взаимодействует с кислотами
S + 2H2SO4(конц) = 3SO2 + 2H2O
S + 6HNO3(конц) = H2SO4 + 6NO2 +2H2O
Получение серы
В промышленности серу получают отделением ее от пустой породы с помощью горячей воды при повышенном давлении. Химическими методами серу получают так:
1. Из отходящих газов металлургических и коксовых печей
2H2S + SO2 → 3S + 2H2O
2. Из природных сульфатов прокаливанием их с углем (процесс идет в несколько стадий)
CaSO4 + 4C = 4CO + CaS
CaS + HOH + CO2 = CaCO3 + H2S
сероводород сжигают:
2H2S + O2 = 2S↓ + 2H2O
Применение серы
Серу используют для производства сернистых органических красителей (CS2), сероуглерода, в производстве искусственного волокна, взрывчатых веществ, в процессах получения серной кислоты.
Сульфиты и гидросульфиты используются как восстановители. Гидросульфит кальция Ca(HSO3)2 применяется при производстве целлюлозы.
Соединения серы со степенью окисления +6
Состояние окисления +6 сера проявляет в соединениях с кислородом, галогенами. Наиболее типичным соединением является триоксид серы SO3. В молекуле SO3 сера находится в состоянии sp2-гибридизации. Молекула представляет собой плоский треугольник. ∟O-S-O = 120º; молекула неполярна (μ = 0).
В молекуле SO3 на 3σ-связи приходится 3π- связи. Молекула прочная, но менее, чем SO2. Молекула SO3 легко полимеризуется. В обычных условиях SO3 – жидкость (т. кип. 44,8˚C), затвердевающая в прозрачную массу (т. пл. 16,8 ºC). SO3 – типичный кислотный оксид, энергично реагирует с основными оксидами. С водой SO3 энергично реагирует с образованием серной кислоты и выделением большого количества тепла.
SO3 + H2O = H2SO4, ΔH = -87,8 кДж
Применяется SO3 в качестве сульфирующего агента в органическом синтезе, в качестве дегидратирующего агента при получении HNO3, для приготовления олеума и т. д.
Серная кислота
H2SO4 – сильная двухосновная кислота. Она представляет собой производное тетраоксосульфат (VI) – иона 2-. В 2- - ионе сера находится в состоянии sp3-гибридизации (4 σ-связи + 2π-связи). Ион 2- имеет форму правильного тетраэдра. Длина связи S-O равна 1,49 Å. Эта связь прочная.
В воде H2SO4 хорошо растворима, при этом выделяется большое количество тепла вследствие образования гидратов состава H2SO4·H2O, H2SO4·2H2O, H2SO4·4H2O. В связи с этим при приготовлении растворов H2SO4 следует кислоту осторожно, тоненькой струйкой вливать в воду, а не наоборот. Концентрированная H2SO4 энергично притягивает влагу и поэтому применяется для осушки газов. Этим же объясняется и обугливание многих органических соединений (углеводов).
C12H22O11 + H2SO4 = 12C + H2SO4∙11H2O
Концентрированная серная кислота может в больших количествах поглощать SO3, образуя при этом пиросерную кислоту H2S2O7. Такие растворы называются олеум. В олеуме существует равновесие H2SO4 + SO3 H2S2O7.
Серная кислота образует два типа солей: средние (сульфаты) Me2+1SO4 и кислые (гидросульфаты) Me+1HSO4. Большинство сульфатов хорошо растворимо в воде. К труднорастворимым относятся сульфаты Ba(II), Ca(II), Sr(II), Pb(II).
Образование труднорастворимого белого осадка BaSO4 является аналитической реакцией на сульфат – ион.
SO42- + Ba2+ = BaSO4 (белый кристаллический осадок)
BaSO4 нерастворим в соляной кислоте.
Некоторые сульфаты, содержащие кристаллизационную воду, называют купоросами. К последним относятся CuSO4·5H2O (медный купорос – голубой цвет), FeSO4·7H2O (железный купорос – зеленый цвет).
Среди солей серной кислоты интересны кристаллогидраты ее двойных солей – квасцы общей формулы Me2+1SO4·Me2(SO4)3·24H2O, где Me+1(Na, K,NH4 и др.), Me+3(Al, Cr, Fe, Co и др.).
Наиболее широко известны: алюмо-калиевые квасцы KAl(SO4)2·12H2O, хромо-калиевые KCr(SO4)2·12H2O, железо-аммониевые (NH4)2·Fe2(SO4)3·24H2O. Применяются квасцы как дубящее средство в кожевенной промышленности, в качестве протравы при крашении тканей, в медицине и т. д.
Функция S (VI ) в окислительно-восстановительных реакциях
Состояние окисления +6 является для серы высшим, и поэтому S+6 функционирует в окислительно-восстановительных реакциях только в качестве окислителя.
Окислительные свойства серы (+6) проявляются только в концентрированной серной кислоте. В разбавленной серной кислоте окислителем является протон Н+. Концентрированная серная кислота является довольно сильным окислителем. Неметаллы (C, S, P) она окисляет до высших оксидов.
S+2H2SO4 = 3SO2 + 2H2O
C + 2H2SO4 = CO2 + 2SO2 +2H2O
HBr и HI серная кислота восстанавливает до свободных галогенов
8HI + H2SO4 = 4I2 + H2S + 4H2O
2HBr +H2SO4 = Br2 + SO2 +2H2O
Концентрированная серная кислота окисляет многие металлы (кроме золота и платины). Железо концентрированная серная кислота пассивирует и поэтому ее можно транспортировать в стальных баллонах. Продуктами восстановления концентрированной серной кислоты могут быть различные соединения серы. Последовательный ряд восстановления серной кислоты
H2S+6O4→S+2O2→S0→H2S-2
Характер продуктов восстановления будет зависеть от активности металла: чем активнее металл, тем глубже восстановление серы (VI).
5H2SO4конц + 4Mg = 4MgSO4 + H2S+ 4H2O
2H2SO4конц + Cu = CuSO4 + SO2 + 2H2O
Zn + 2H2SO4конц = ZnSO4 + SO2 + 2H2O
При действии разбавленной серной кислоты на металлы продуктом восстановления является Н2 и растворяются в разбавленной серной кислоте только металлы, стоящие в электрохимическом ряду до водорода.
H2SO4разб + Zn = ZnSO4 + H2
3Zn + 4H2SO4разб = S↓ + 3ZnSO4 + 4H2O
4Zn + 5H2SO4 очень разб = H2S + 4ZnSO4 + 4H2O
Получение серной кислоты
Сущность промышленного способа получения серной кислоты заключается в окислении диоксида серы SO2 до триоксида серы SO3 и превращением последнего в серную кислоту. Схему получения можно представить в следующем виде:
FeS2 SO2 SO3 H2SO4
Этот процесс осуществляется двумя способами: контактным и нитрозным. В контактном методе получения серной кислоты в качестве катализатора для окисления SO2 используют ванадиевый ангидрид V2O5 с добавлением K2SO4 или PbSO4. В нитрозном способе получения серной кислоты катализатором, ускоряющим окисление SO2 в SO3, служит оксид азота NO.
Применение серной кислоты
Серная кислота является одним из важнейших продуктов основной химической промышленности. Большинство химических соединений получается при прямом или косвенном участии серной кислоты. Широко используется серная кислота в производстве минеральных удобрений.
Она употребляется для получения многих минеральных кислот и солей, используется в органическом синтезе, при производствах взрывчатых веществ, красителей, в текстильной, кожевенной и других отраслях промышленности.
Пероксосерные кислоты – это кислородные кислоты серы, характеризующиеся наличием пероксо-группы – О-О. Хорошо известны две пероксокислоты серы: пероксомоносерная H2SO5 и пероксодисерная H2S2O8.
Пероксомоносерная кислота (кислота Каро) H2SO5 является пероксидной формой серной кислоты
H – O – O – S – O – H
H2SO5 относится к числу сильных одноосновных кислот. Подобно пероксиду водорода она неустойчива и является очень сильным окислителем.
2KI + H2SO5 = K2SO4 + I2 + H2O
Получают H2SO5 в качестве окислителя в органическом синтезе. Пероксодисерная кислота H2S2O8 имеет строение
H – O – S – O – O – S – O – H
Она также относится к производным пероксида водорода, является очень сильным окислителем (может окислять Cr+3 → Cr+6, Mn+2 → Mn+7, 2I - → I0)
2KI + H2S2O8 = 2KHSO4 + I2
H2SO5 и H2S2O8 гидролизуются с образованием пероксида водорода и поэтому их используют при промышленном получении растворов Н2О2
H2S2O8 + 2H2O = 2H2SO4 + H2O2
H2SO5 + H2O = H2SO4 + H2O2
Тиокислоты серы
Тиокислоты представляют собой производные кислородных кислот, в которых часть или все атомы кислорода замещены серой. Соли тиокислот называются тиосолями. Примером тиокислот является тиосерная кислота H2S2O3 представляющая собой производное серной кислоты, в которой один атом кислорода замещен атомом серы. Структурная формула ее имеет вид
Na2SO3S-2 + 4Cl2 + 5H2O = 2H2SO4 + 6HCl + 2NaCl
Na2S2O3 + Cl2 + H2O = S↓ + Na2SO4 + 2HCl.
При взаимодействии тиосульфата со слабыми окислителями (I2, Fe3+ и другие) образуется тетратионат–ион S4O62-. Реакция между тиосульфатом натрия и солями железа (III) используется для обнаружения тиосульфат-ионов. Реакция протекает следующим образом
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
2FeCl3 + 2Na2S2O3 = 2FCl2 + Na2S4O6 + 2NaCl
При протекании этой реакции образуется промежуточное соединение, окрашено в темно-фиолетовый цвет - Cl. Это неустойчивый комплекс Fe3+, который быстро разлагается по реакции внутримолекулярного окисления-восстановления по схеме
2+ = 2Fe2+ + S4O62-
При этом окраска исчезает.
Кроме того, для H2S2O3 характерны реакции, протекающие по механизму внутримолекулярного окисления-восстановления
H2S2O3 = H2+4SO4 + S0
Этим объясняется неустойчивость тиосерной кислоты. Тиосульфат натрия применяется в фотографии (закрепитель), в текстильной промышленности, медицине.
Шестая группа периодической системы элементов состоит из двух подгрупп: главной - кислород, сера, селен, теллур и полоний - и побочной - хром, молибден и вольфрам. В главной подгруппе выделяют подгруппу селена (селен, теллур и полоний), побочную подгруппу называют подгруппой хрома. Все элементы главной подгруппы, кроме кислорода, могут присоединять по два электрона, образуя электроотрицательные ионы.
Элементы главной подгруппы имеют на внешнем электронном
уровне по шесть электронов (s2р4). Атомы кислорода имеют два неспаренных электрона и не имеют d-уровня. Поэтому кислород проявляет в основном степень окисления -2 и только в соединениях со фтором +2. Сера, селен, теллур и полоний тоже имеют на внешнем уровне шесть электронов (s2p4), но у всех у них есть незаполненный d-уровень, поэтому они могут иметь до шести неспаренных электронов и в соединениях проявлять степень окисления - 2, +4 и +6.
Закономерность изменения активности этих элементов такая же, как и в подгруппе галогенов: легче всего окисляются теллуриды, затем селениды и сульфиды. Из кислородных соединений серы наиболее устойчивы соединения серы (VI), а для теллура - соединения теллура (IV). Соединения селена занимают промежуточное положение.
Селен и теллур, а также их соединения с некоторыми металлами (индием, таллием и др.) обладают полупроводниковыми свойствами и широко используются в радиоэлектронике. Соединения селена и теллура очень токсичны. Они применяются в стекольной промышленности для получения цветных (красных и коричневых) стекол.
В элементах подгруппы хрома идет заполнение d-уровня, поэтому на s-уровне их атомов - по одному (у хрома и молибдена) или два (у вольфрама) электрона. Все, они проявляют максимальную степень окисления +6, но для молибдена, и особенно для хрома, характерны соединения, в которых они имеют более низкую степень окисления (+4 для молибдена и +3 или +2 для хрома). Соединения хрома (III) очень устойчивы и похожи на соединения алюминия. Все металлы подгруппы хрома находят широкое применение.
Молибден был впервые получен К. В. Шееле в 1778 г. Он используется в производстве сталей высокой прочности и вязкости, применяющихся для изготовления оружейных стволов, брони, валов и др. Из-за способности испаряться при высокой температуре он мало пригоден для изготовления нитей накала, но обладает хорошей способностью сплавляться со стеклом, поэтому используется для изготовления держателей вольфрамовых нитей в лампах накаливания.
Вольфрам был открыт также К. В. Шееле в 178! г. Он применяется для получения специальных сталей. Добавка вольфрама к стали увеличивает ее твердость, эластичность и прочность. Вместе с хромом вольфрам придает стали свойство сохранять твердость при очень высоких температурах, поэтому такие стали применяются для изготовления резцов к быстрорежущим токарным станкам. Чистый вольфрам обладает наивысшей среди металлов температурой плавления (3370 °С), поэтому применяется для изготовления нитей в лампах накаливания. Карбид вольфрама отличается очень большой твердостью и термостойкостью и является основной составной частью тугоплавких сплавов.
72. Кислород
Кислород был открыт шведским химиком К. В. Шееле в 1769-1770 гг. и английским химиком Д. Ж. Пристли в 1774 г.
Нахождение в природе . Кислород является наиболее распространенным элементом в природе. Содержание его в земной коре составляет 47,00 % по массе. В свободном состоянии он содержится в атмосфере (около 23 % по массе), входит в состав воды (88,9 %), всех оксидов, из которых состоит земная кора, кислородсодержащих солей, а также многих органических веществ растительного и животного происхождения.
ЕЖОВНИК (анабазис) , род многолетних трав или полукустарничков семейства маревых. Ок. 30 видов, в Центр. Азии, на юге Европы, в Сев. Африке, но главным образом в Ср. Азии. Некоторые виды - пастбищный корм верблюдов, овец. Иногда ежовником называют также некоторые виды семейства злаков (пайзу, куриное просо).
НИЛЬСБОРИЙ (лат. Nielsbohrium), Ns, искусственно полученный радиоактивный химический элемент V гр. периодической системы, атомный номер 105. Наиболее устойчивый изотоп 262Ns (период полураспада 40 с). Получен в 1970 в СССР и США. Назван по предложению советских физиков по имени Нильса Бора; американские ученые предложили название "ганий" в честь О. Гана. Название окончательно не принято.
КОКОВ Валерий Мухамедович (р. 1941), российский государственный деятель, президент Кабардино-Балкарской Республики (1993). В 1990-91 председатель Верховного Совета Кабардино-Балкарской АССР, в 1991-92 первый заместитель председателя Совета Министров Кабардино-Балкарской Республики. В 1993-95 депутат Совета Федерации Федерального Собрания Российской Федерации, с 1995 член Совета Федерации. В 1997 избран президентом на второй срок.
Халькогены(образующие руды) – это p-элементы, структура внешней оболочки, кот. ns 2 np 4 где n – № периода. На внешней оболочке эти элементы имеют по 6 электронов, два из кот. неспарены. Поэт. проявляют валентность 2, но атомы халькогенов, кроме кислорода могут переходить в возб. состояние, увеличивая число неспаренных электронов до 4,6. S 3 ↓ ↓ + квант света = S 3
Аналогично для селена и теллура. Т. о. есть валентности 4,6. Атомы кислорода не могут переходить в возбужденное состояние из-за отсутствия свободных орбиталей на внешней электронной оболочке. Поэтому кислород не может проявлять валентность равную № группы. В большинстве соединений кислород проявляет валентность 2, но учитывая 2 механизма ковалентной связи, для него максимальная ковалентность 4. В некоторых соединениях бывает валентность 3, степени окисления +2, -2. О +2 ≡ О -2 .
В эту подгруппу кроме кислорода входит радиоактивный полоний. До завершения внешней электронной оболочки атомам всех халькогенов не хватает по 2 электрона, принимая их, они приобретают найменшую степень окисления -2, характерную для всех элементов 6А группы. О 0 + 2е =О -2 оксид-ион, S 0 + 2е = S -2 сульфид-ион.
Кроме этого атомы могут отдавать 2е,4е,6е(кроме кислорода), приобретая положительные степени окисления. S 0 - 2е = S +2 , S 0 - 4е = S +4 , S 0 - 6е = S +6 .Нечетные степени окисления не устойчивы. У серы есть промежуточные степени окисления -1,-0,5. [О 2 ] -2 степень окисления -1, [О 2 ] -1 степень окисления -0,5 условно. Для О 2 степени окисления: -2,-1 в пероксидах; 0; +1;+2 во фторидах; +4 в О 3 - О +4 О -2 О -2 .
Для остальных: -2,-1 в персульфидах; 0; +2 ; +4,+6.
В подгруппе сверху вниз неметалл.(окислительные) способность уменьшается, мет.(восст.) – увеличивается, энер. иониз., сродство к е, ЭО –уменьшаются, увеличивается радиус атома.
О 2 – газ без цвета и запаха, 21% по объёму в воздухе, молекула 2 атомна, связь ковалентная неполярная, есть неспареные электроны, по методу МО парамагнитна.
Сера, селен, теллур – твердые в-ва с различными аллотропными модификациями.
Соединения с водородом. H 2 O – жидкость – аномалия, причина водородные связи, аномально высокая t пл. и t кип. из-за водородных связей. Остальные H 2 S, H 2 Sе, H 2 Те- газы, растворимы в воде, р-ры- это слабые кислоты- слабые электролиты. В ряду H 2 S, H 2 Sе, H 2 Те t пл. и t кип. Увеличивается т. к. усложняется структура электронных оболочек анионов.
Устойчивость соединений падает, полярность молекулы уменьшается, длинна связи увеличивается, энергия связи уменьшается, кислотные св-ва уменьшаются, восстановительные св-ва возрастают, увеличивается радиус.Соединения с кислородом. Элемент О 2 – образует оксиды, для оксидов остальных элементов характерны кислотные св-ва.
SО 2 - H 2 SО 3 сернистая к-та SеО 2 - H 2 SеО 3 селенистая к-та
ТеО 2 - H 2 ТеО 3 теллуристая к-та. Сверху вниз сила кислот уменьшается.
SО 3 - H 2 SО 4 серная к-та SеО 3 - H 2 SеО 4 селеновая к-та
ТеО 3 - H 2 ТеО 4 теллуровая к-та. Сверху вниз сила кислот уменьшается.
В ряду H 2 SО 3 - H 2 SО 4. Сила кислот увеличивается.
Серная кислота – одна из самых важных минеральных кислот. Ее химические особенности. Получение и практическое применение. H 2 SO 4 - тяжелая бесцветная жидкость, обладает сильными гидроскопическими свойствами. Очень интенсивно поглощает влагу, поэтому применяется как дегидротирующее средство, применяется для осушения газов. Смешивается с водой в любом соотношении. Техника безопасности с H 2 SO 4 (к) : нельзя вливать воду в кислоту, H 2 SO 4 обугливает орг. Вещества, вызывает ожоги. Если концентрация кислоты 70% и выше то к-та конц. Если меньше – разбавленная. В молекуле H 2 SO 4 находится два окислителя Н + и S +6 . Ок-восст. потенциал S +6 больше чем Н + . Ок-восст. свойства H 2 SO 4 должна проявлять за счет S +6 , но в разб. виде H 2 SO 4 – сильный электролит и находится в растворе в виде ионов - H 3 O + и SO 4 2- . H 2 SO 4 (р) проявляет за счет H 3 O + . В конц. виде H 2 SO 4 - слабый электролит, в р-ре будет в молекулярном виде, поэтому проявляет ок.-восст. свойства за счет S +6 H 2 SO 4 (р) проявляет всеобщие свойства кислот: 1) с осн. и амфотерными оксидами CaO+H 2 SO 4 =CaSO 4 + H 2 O ZnO+ H 2 SO 4 =ZnSO 4 + H 2 O 2) со щелочами, нерастворимыми основаниями 2KOH+ H 2 SO 4 =K 2 SO 4 + H 2 O Cu(OH) 2 + H 2 SO 4 =CuSO 4 + 2H 2 O 3) с солями, если образуется осадок или газ K 2 CO 3 + H 2 SO 4 =K 2 SO 4 + CO 2 +H 2 O 4) с аммиаком или его водным раствором 2NH 3 + H 2 SO 4 =(NH 4) 2 SO 4 NH 3 *H 2 O+ H 2 SO 4 =NH 4 SO 4 +H 2 O H 2 SO 4 (к) – это кислота окислитель (S +6), продукты восстановления, зависят от двух факторов: 1) от активности восстановителя 2) от концентрации кислоты. Свойства: 1) окисляет щел. и щел.-зем. металлы. 8Na+5 H 2 SO 4 (к)=4Na 2 SO 4 +H 2 S+4 H 2 O 2) окисляет остальные металлы с Е 0 =(-)(до H 2), продукт восст.-я зависит от конц-ии кис-лоты Zn+ 2H 2 SO 4 (к)=ZnSO 4 + SO 2 +2 H 2 O 3Zn+4H 2 SO 4 (к)(80%)= 3ZnSO 4 +S+4H 2 O 4Zn+ 5H 2 SO 4 (к)(70%)=4ZnSO 4 + H 2 S+4H 2 O 3) Al , Cr, Fe пассивируют H 2 SO 4 (к)(покрываются оксидной пленкой которая мешает дальнейшему окислению) 4) Окисляет металлы с Е 0 =(+)(после H 2) Cu+2 H 2 SO 4 (к)= CuSO 4 + SO 2 +2 H 2 O 5) Pt, Au не взаимодействуют. 6) Окисляет неметаллы (С,F,S) C+ 2H 2 SO 4 (к)= CO 2 + 2SO 2 +2 H 2 O 7) Окисляет сложные вещества
Получение. В промышленности:1) контактный 2)нейтрозный способы. Контактный, 3 стадии:
1) Обжиг пирита 4FeS 2 + 11 O 2 = t 2Fe 2 O 3 +8SO 2
2) Окисление SO 2 в SO 3 2 SО 2 + O 2 =2SO 3
3) Растворение SO 3 в H 2 SO 4 (к) nSO 3 +H 2 SO 4 (к)= (H 2 SO 4 * nSO 3)- олеум. Олеум растворяют водой и получают H 2 SO 4 SO 3 + H 2 O= H 2 SO 4 Серная кислота применяется в различных органических синтезах, в народном хозяйстве, главный продукт химической промышленности.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru
ХИМИЯ ЭЛЕМЕНТОВ VI ГРУППЫ
16-ю группу периодической таблицы химических элементов Д.И. Менделеева составляют Халькогемны (от греч. чблкпт -- медь (в широком смысле), руда (в узком смысле) и генпт -- рождающий). Это такие химические элементы, как кислород (O), сера (S), селен (Se), теллур (Te), радиоактивный полоний (Po), и искусственно полученный ливерморий (Lv). Все эти элементы встречаются в природе (за исключением Lv), причем каждый из них имеет несколько природных изотопов (за исключением Po). Все они являются р-элементами. Строение валентного уровня их электронных оболочек соответствует формуле ns 2 np 4 .
кислород сера селен теллур полоний
1. Кислород
Самый распространённый элемент на Земле: в воздухе - 21% по объему (находится в виде О 2 и О 3), в земной коре - 49 % по массе, в гидросфере - 89% по массе, в составе живых организмов - до 65% по массе. В земной коре он содержится в виде различных минералов, которые представляют собой оксиды (например, Al 2 O 3 , SiO 2 , Cu 2 O, SnO 2) и соли (например, FeCO 3 , CaSO 4 , Ca 3 (PO 4) 2).
Атом
Порядковый № 8, электронное строение: 1s 2 2s 2 2p 4
Валентность
II, в СО - валентность III за счет ДАС.
Степени окисления
1) -2 - оксиды, гидроксиды, соли;
2) -1 - пероксиды;
3) -1/2, -1/3 - надпероксиды, озониды;
4) +2 - ОF 2 , +1 - O 2 F 2 .
Электроотрицательность
Изотопы природного кислорода
О (99,76%), О (0,04%), О (0,20%).
Физические свойства
Кислород - газ без цвета, запаха и вкуса, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород - голубоватая жидкость, кипящая при -183 0 С. Притягивается магнитом. Твердый кислород - синие кристаллы, плавящиеся при -218,7 0 С.
Строение молекулы
Молекула состоит из двух атомов, связанных двойной связью. Связь - ковалентная неполярная.
Аллотропные модификации (изменения)
О 2 и О 3 (озон).
Способы получения
1) Промышленный способ: перегонка жидкого воздуха;
2) Лабораторный способ: разложение (воздействие t 0 C) некоторых кислородсодержащих веществ
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
2KClO 3 = 2KCl + 3O 2 (k - MnO 2)
2H2O2 = 2H2O + O2 (k - MnO 2)
2HgO = 2Hg + O 2
2KNO 3 = 2KNO 2 + O 2
Способы собирания кислорода
Химические свойства
1) Взаимодействие с НеMet (кроме фтора и благородных газов): образуются ОКСИДЫ - бинарные соединения с кислородом в степени окисления -2:
Si + O 2 = SiO 2 (t=400-500 0 С)
· При взаимодействии с углеродом, фосфором и мышьяком в зависимости от количества кислорода образуются разные оксиды:
С + О 2(изб) = СО2; С + О 2(нед) = СО
· При взаимодействии с серой последняя окисляется до сернистого газа (дальнейшее воздействие кислородом приводит к образованию высшего оксида - SO 3):
· При взаимодействии с фтором образуется ФТОРИД кислорода:
2F 2 + O 2 = 2OF 2
2) Взаимодействие с Met: образуются основные и амфотерные оксиды:
4Al + 3O 2 = 2AL 2 O 3
· При взаимодействии с натрием образуется пероксид:
Na + O 2 = Na 2 O 2
· При взаимодействии с калием, рубидием и цезием образуются надпероксиды:
· При взаимодействии с железом образуется смесь оксидов:
3Fe + 2O 2 = Fe 3 O 4 (Fe 2 O 3 *FeO)
· При взаимодействии с марганцем образуется диоксид марганца:
3) Взаимодействие со сложными веществами:
· Горение и обжиг сульфидов, водородных соединений:
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O
CH 4 + 2O 2 = CO 2 + 2H 2 O
· Окисление низших оксидов до высших:
FeO + O 2 = Fe 2 O 3
· Окисление гидроксидов и солей в водных растворах: если вещество неустойчиво на воздухе:
2HNO 2 + O 2 = 2HNO 3
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3
· Окисление в присутствие катализаторов:
аммиака: NH 3 + O 2 = NO + H 2 O
органических веществ: C 2 H 5 OH + O 2 = CH 3 -COH и т.п. (k - Cu; t 0 C)
Применение кислорода
Кислород применяют в медицине, на взрывных работах, для сварки металлов, для резки металлов, в авиации для дыхания, в авиации для двигателей, в металлургии.
CH 4 + 2O 2 = CO 2 + 2H 2 O
C 6 H 10 O 5 + 6O 2 = 5CO 2 + 6H 2 O
Во всех этих процессах образуется оксид углерода (IV). Единственный естественный природный процесс связывания оксида углерода (IV) - процесс фотосинтеза, проходящий в зеленых растениях под действие солнечного света:
6CO 2 + 6H 2 O = C 5 H 12 O 6 + O 2 (k - hv)
При этом образуется глюкоза - основа для строительства тканей растений.
Если какое-либо вещество медленно реагирует с кислородом, то такое окисление называют медленным. Это, например, процессы разложения пищевых продуктов, гниения.
Озон
Озон - это аллотропная модификация кислорода.
Физические свойства
Газ, с запахом свежей хвои, бесцветен.
Получение
1) Озонирование воздуха: 3O 2 2O 3
2) Во время грозы (в природе);
3) В лаборатории - в озонаторе.
Химические свойства
1) Неустойчив, легко распадается: O 3 O 2 + O . . При этом образуется АТОМАРНЫЙ кислород, очень сильный окислитель. Он обесцвечивает красящие вещества, отражает УФ-лучи, уничтожает микроорганизмы;
2) Сильный окислитель, сильнее кислорода:
6NO 2 + O 3 = 3N 2 O 5
3PbS + 4O 3 = 3PbSO 4
3) Качественная реакция на озон: реакция с йодидом калия, появляется желто-коричневая окраска йода:
2KI + O 3 = 2KOH + I 2 + O 2
Пероксид водорода
Стоит уделить особое внимание этому веществу, так как из всех соединений кислорода именно пероксид водорода чаще всего используют как стерилизационное и антисептическое средство.
Строение молекулы
Н 2 О 2 или Н-О-О-Н
Физические свойства
Это бесцветная неустойчивая жидкость. Плотность составляет 1,45 г/см 3 . Ее концентрированный раствор (30%) взрывоопасен и называется пергидролем.
Получение
Гидролиз пероксидов металлов водой или кислотами:
BaO 2 + H 2 SO 4 = H 2 O 2 + BaSO 4
Химические свойства
1) Разложение:
2H 2 O 2 = 2H 2 O + O 2 (t 0 C, k - MnO 2)
2) Пероксид водорода может быть как окислителем, так и восстановителем:
· Окислительные свойства более характерны - переходит в Н 2 О или ОН - :
Na 2 S +4 O 3 + H 2 O 2 = Na 2 S +6 O 4 + Н 2 О
(неметаллы в промежуточной степени окисления окисляет в высшую степень окисления)
2Fe(OH) 2 + H 2 O 2 = 2Fe(OH) 3
2KI + H 2 O 2 + H 2 SO 4 = I 2 + K 2 SO 4 + 2H 2 O
PbS + 4H 2 O 2 = PbSO 4 + 4H 2 O
(сульфиды переходят в сульфаты)
2Cr +3 Cl 3 + 3H 2 O 2 + 10KOH = 2K 2 Cr +6 O 4 + 6KCl + 8H 2 0
(любые соединения хрома +3 окисляет в +6)
· Восстановительные свойства - переходит в О 2:
CaOCl 2 + H 2 O 2 = CaCl 2 + O 2 + H 2 O
2KMnO 4 + 5H 2 O 2 + 3H 2 SO 4 = 2MnSO 4 + K 2 SO 4 + 5O 2 + 8H 2 O
K 2 Cr 2 O 7 + 3H 2 O 2 + 4H 2 SO 4 = Cr 2 (SO 4) 3 + K 2 SO 4 + 3O 2 + 7H 2 O
Пероксиды и надпероксиды металлов
Химические свойства этих соединений имеют свою особенность: в ОВР, а также в реакциях разложения водой образуется кислород:
Химические свойства
1) Разложение водой:
Na 2 O 2 + H 2 O = H 2 O 2 + NaOH
K 2 O 2 + H 2 O = H 2 O 2 + O 2 + KOH (при t 0 C)
2) Они являются сильными окислителями:
KO 2 + Al = KAlO 2
3) В некоторых реакциях проявляют восстановительные свойства:
2KMnO 4 + 5Na 2 O 2 + 8H 2 SO 4 = 2MnSO 4 + K 2 SO 4 + 5Na 2 SO 4 + 5O 2 + 8H 2 O
4) Взаимодействуют с углекислым газом:
Na 2 O 2 + CO 2 = Na 2 CO 3 + O 2
Получение
1) Me (щелочные и Ва) + кислород:
Na + O 2 = Na 2 O 2
2) Оксиды металлов + кислород:
2K 2 O + 3O 2 = 4KO 2
2. Сера
Сера -- элемент 16-й группы, третьего периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. sulfur).
Атом
Порядковый № 16, электронное строение: 1s 2 2s 2 2p 6 3s 2 3p 4 .
Валентность
Степени окисления
1) -2 - сульфиды;
2) 0 - атом;
3) +4 - соли, кислоты;
4) +6 - соли, кислоты.
Электроотрицательность
Физические свойства
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t кип = 445 0 С.
Аллотропные модификации
1) Кристаллическая:
· Ромбическая сера - S 8 - наиболее устойчивая модификация;
· Моноклинная сера - темно-желтые иглы. Устойчива при температуре более 960С, при обычных условиях - превращается в ромбическую;
2) Пластическая сера - коричневая резиноподобная (аморфная) масса.
Нахождение в природе
1) Самородная сера;
2) Сульфиды: цинка ZnS, ртути PbS (киноварь), железа FeS 2 (пирит);
3) Сульфаты: гипс CaSO 4 *2H 2 O, глауберова соль Na 2 SO 4 *10H 2 O.
Получение серы
1) Метод термического разложения сульфидов:
2) Восстановление диоксида серы (IV) углеродом: SO 2 - побочный продукт при выплавке металлов из сернистых руд
SO 2 + C = S + CO 2
3) Окисление сероводорода недостатком кислорода либо диоксидом серы (IV) в смеси SO 2 и H 2 O (отходящие пары металлургических и коксовых батарей):
2H 2 S + O 2 = 2S + 2H 2 O
2H 2 S + SO 2 = 3S + 2H 2 O
(последняя реакция проходит также в природе при извержении вулканов)
4) Выделение из природного газа, нефти и сопутствующих нефтепродуктов.
Химические свойства
В нормальных условиях химическая активность серы невелика, но при нагревании сера весьма активна и может быть как окислителем, так и восстановителем.
1) Взаимодействие с Ме:
· Со щелочными Ме без нагревания:
2Na + S = Na 2 S
· С остальными Ме (кроме Au, Pt) - при повышенной температуре:
2Al + 3S = Al 2 S 3
2) Взаимодействие с НеМе:
· С водородом: H 2 + S = H 2 S;
· С фосфором: 2P + 3S = P 2 S 3 ;
· С кислородом: S + O 2 = SO 4 ;
· С галогенами: химическая активность серы по отношению к галогенам падает в ряду от фтора к йоду: с фтором сера взаимодействует при комнатной температуре, с бромом и хлором - при нагревании, с йодом соединений не получено: S + Cl 2 = SCl 2
· С углеродом: C + S = CS 2
3) Взаимодействие с кислотами-окислителями (при нагревании):
S + 6HNO 3 (конц) = H 2 SO 4 + 6NO 2 + 2H 2 O
4) Взаимодействие со щелочью (диспропорционирование):
3S 0 + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O (кипячение)
Применение серы
Серу применяют для получения серной кислоты, для вулканизации каучуков, в производстве спичек и черного пороха, как лекарственное средство, входящее в состав мазей против кожных заболеваний.
В сельском хозяйстве серу в виде тонкого порошка используют для борьбы с болезнями растений, пчел и других домашних животных.
В быту очень часто применяют серу для связывания токсичной ртути в сульфид ртути с последующим его удалением.
Сероводород
Молекула сероводорода имеет угловую форму, как и молекула воды, с атомом серы в центре. Однако, в отличие от воды, молекулы сероводорода не способны к образованию между собой водородных связей.
Сероводород - бесцветный газ с характерным запахом тухлых яиц,
t кип = -60 0 С.
Раствор сероводорода в воде называют сероводородной кислотой - это очень слабая двухосновная кислота (слабее угольной). Сероводород очень токсичен.
Сероводород входит в состав вулканических газов, а также содержится в воде некоторых минеральных источников.
Получение
1) В природе сероводород образуется при гниении белков;
2) В лаборатории его получают следующими способами:
· Прямой синтез из простых веществ:
· Вытеснением из сульфидов, в ряду напряжения стоящих левее железа:
FeS + 2HCl = FeCl 2 + H 2 S
· Гидролиз сульфида алюминия на холоде:
Химические свойства
Сероводород в реакциях проявляет свойства сильного восстановителя.
1) Взаимодействие с кислородом воздуха при нагревании до 700 0 С (со взрывом):
2H 2 S + 3O 2 (изб) = 2SO 2 + 2H 2 O + Q
2H 2 S + O 2 (нед) = 2H 2 O + 2S
2) Взаимодействие с галогенами:
H 2 S + I 2 = 2HI + S
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl
3) Взаимодействие со щелочами: образует два ряда солей - средние (сульфиды) и кислые (гидросульфиды):
H 2 S + 2NaOH = Na 2 S + 2H 2 O
H 2 S + NaOH = NaHS + H 2 O
4) Взаимодействие с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя ЧЕРНЫЕ очень малорастворимые сульфиды:
5) Взаимодействие с окислителями средней активности с образованием серы и с сильными окислителями - окисляется до серной кислоты:
H 2 S + Br 2 = S + 2HBr
H 2 S + 2FeCl 3 = 2FeCl 2 + S + 2HCl
H 2 S + 4Cl 2 + H 2 O = H 2 SO 4 + 8HCl
3H 2 S + HNO 3 (конц) = 3H 2 SO 4 + 8NO + 4H 2 O
H 2 S + 3H 2 SO 4 (конц) = 4SO 2 + 4H 2 O
H 2 S + 4PbO 2 = H 2 SО 4 + 4PbO
6) При нагревании разлагается до простых веществ:
7) Взаимодействие с серебром:
2H 2 S + 4Ag + O 2 = 2Ag 2 S + 2H 2 O
8) Диссоциация в воде: в основном по первой ступени:
HS - H + + S 2- (редко)
9) Качественная реакция на сероводород и растворимые сульфиды - образование темно-коричневого (почти черного) осадка PbS:
H 2 S + Pb(NO 3) 2 = PbS + 2HNO 3
Na 2 S + Pb(NO 3) 2 = PbS + 2NaNO 3
Сульфиды
Классификация сульфидов
|
Растворимые в воде. |
Нерастворимые в воде, но растворимые в минеральных кислотах (соляной, фосфорной, разбавленной серной). |
Нерастворимые ни в воде, ни в минеральных кислотах - только в кислотах-окислителях. |
Гидролизуемые водой, не существующие в водных растворах. |
|
|
Сульфиды щелочных Ме и аммония. |
Белые и цветные сульфиды: ZnS, MnS, FeS, CdS. |
Черные сульфиды: CuS, HgS, PbS, Ag 2 S, NiS, CoS. |
Сульфиды алюминия, хрома (III), железа (III) |
|
|
Можно вытеснить сероводород, действуя соляной кислотой: FeS + 2HCl = FeCl 2 + H 2 S |
НЕЛЬЗЯ получить сероводород из этих сульфидов! |
Водой полностью разлагаются: Al 2 S 3 + 6H 2 O = 2Al(OH) 3 + H 2 S |
Получение
1) Нагревание Ме с серой:
2Cr + 3S = Cr 2 S 3
2) Растворимые сульфиды получают действием сероводорода на щелочь:
H 2 S + 2KOH = K 2 S + 2H 2 O
3) Нерастворимые сульфиды получают обменными реакциями:
H 2 S + Pb(NO 3) 2 = PbS + 2HNO 3
(только нерастворимые в кислотах сульфиды)
ZnSO 4 + Na 2 S = Na 2 SO 4 + ZnS
(любые нерастворимые в воде сульфиды)
Химические свойства
1) Растворимые сульфиды гидролизуются по аниону, среда щелочная:
K 2 S + H 2 OKHS + KOH
S 2- + H 2 OHS - + OH -
2) Сульфиды Ме, стоящих в ряду напряжений левее железа (включительно), растворимы в сильных минеральных кислотах:
FeS + 2HCl = FeCl 2 + H 2 S
3) Нерастворимые сульфиды можно перевести в растворимое состояние (окислить) действием концентрированной азотной кислоты:
3CuS + 14HNO 3 = 3Cu(NO 3) 2 + 3H 2 SO 4 + 8NO + 4H 2 O
4) Сульфиды можно превратить в сульфаты перекисью водорода:
CuS + H 2 O 2 = CuSO 4 + 4H 2 O
5) При обжиге сульфидов кислородом образуются оксиды:
2ZnS + 3O 2 = 2ZnO + 2SO 2
Оксиды серы
Оксид серы (IV )
SO 2 - сернистый ангидрид, сернистый газ (без цвета с резким запахом, хорошо растворим в воде).
Степень окисления серы в этом соединении: +4
Поскольку атом серы в соединении имеет промежуточную степень окисления, то в реакциях (в зависимости от окислительно-восстановительных свойств других реагентов) оно играет роль как восстановитель, так и окислитель. Кроме того, оно может вступать в реакции без изменения степени окисления.
Получение
1) При сжигании серы в кислороде:
2) Окислением сульфидов:
2ZnS + 3O 2 = 2ZnO + 2SO 2
3) Обработкой солей сернистой кислоты минеральными кислотами:
Na 2 SO3 + 2HCl = 2NaCl + SO 2 + H 2 O
4) При обработке серной кислотой (конц) некоторых металлов:
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O
Химические свойства
1) Сернистый ангидрид - кислотный оксид. Реагирует с водой, основными оксидами и щелочами:
SO 2 + H 2 O = H 2 SO 3
BaO + SO 2 = BaSO 3
Ba(OH) 2 + SO 2 = BaSO 3 + H 2 O
Ba(OH) 2 + 2SO 2 = Ba(HSO 3) 2
2) Реакции окисления (S +4 -2зS +6):
SO 2 + Br 2 + 2H 2 O = H 2 SO 4 + 2HBr
5SO 2 + 2KMnO 4 + 2H 2 O = K 2 SO 4 = 2MnSO 4 + 2H 2 SO 4
3) Реакции восстановления (S +4 +4зS 0):
SO 2 + C = S + CO 2
SO 2 + 2H 2 S = 3S + 2H 2 O
Оксид серы (VI )
SO 3 - серный ангидрид. Бесцветная летучая жидкость с удушающим запахом (t кип =43 0 C); на воздухе «дымит», гигроскопична: SO 3 + H 2 O = H 2 SO 4 + Q.
В этом соединении сера имеет высшую степень окисления +6. Поэтому серный ангидрид - активный окислитель.
Химическая активность оксида серы (VI) оченб высока. Взаимодействует с водой, основными и амфотерными оксидами, щелочами.
Получение:
1) Каталитическое окисление SO 2 кислородом воздуха:
2SO 2 + O 2 = 2SO 3 + Q (t 0 C, k - V 2 O 5)
2) Термическое разложение сульфатов:
Fe 2 (SO 4) 3 = Fe 2 O 3 + 3SO 3 (t 0 C)
3) Взаимодействие SO 2 с озоном:
SO 2 + O 3 = SO 3 + O 2
4) Взаимодействие SO 2 и NO 2:
SO 2 + NO 2 = SO 3 + NO
Химические свойства:
1) Взаимодействие с водой - образование сильной двухосновной серной кислоты:
SO 3 + H 2 O = H 2 SO 4 + Q.
2) Взаимодействие с основаниями:
2NaOH (изб) + SO 3 = Na 2 SO 4 + H 2 O
NaOH + SO 3 (изб) = NaHSO 4
3) Взаимодействие с основными оксидами:
CaO + SO 3 = CaSO 4
4) Растворение в концентрированной серной кислоте - образование ОЛЕУМА:
H 2 SO 4 (конц) + SO 3 = H 2 S 2 O 7
H 2 SO 4 (конц) + 2SO 3 = H 2 S 3 O 10
Применение:
Серный ангидрид применяют в основном для получения серной кислоты.
Кислоты серы и их соли
Сернистая кислота и её соли
H 2 SO 3 - образуется при реакции оксида серы (IV) с водой и существует только в виде раствора. Это слабая, летучая, неустойчивая двухосновная кислот. H 2 SO 3 образует средние (сульфиты) и кислые (гидросульфиты) соли. Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями, хотя в присутствии более сильных восстановителей способны проявлять окислительные свойства.
Химические свойства:
1) Участие в реакции ОВР:
· Проявление свойств восстановителя:
2Na 2 S +4 O 3 + O 2 0 = 2Na 2 S +6 O 4 -2
· Проявление свойств окислителя:
Na 2 SO 3 + S = Na 2 S 2 O 3 - гипосульфит натрия (t 0 C)
2) Термическое разложение сульфитов:
4Na 2 SO 3 - Na 2 S + 3Na 2 SO 4 (t 0 C)
3) Гидролиз растворимых в воде сульфитов - гидролиз по аниону - среда щелочная:
K 2 SO 3 + HOH = KHSO 3 + KOH
Серная кислота и её соли
Физические свойства:
Серная кислота (100%-ная) - бесцветная тяжелая маслянистая жидкость («купоросное масло»); плотность = 1,84 г/см 3 , t пл = 10,3 0 C, t кип = 296 0 C; не имеющая запах, нелетучая хорошо растворимая в воде. Серная кислота смешивается с водой в любых соотношениях. Она очень гигроскопична - активно поглощает пары воды, поэтому её используют в качестве осушителя как в лаборатории, так и в быту.
Получение:
В настоящее время для получения серной кислоты используется контактный метод. Этот метод позволяет получить очень чистую серную кислоту любой концентрации, а также олеум.
Исходным сырьём для производства серной кислоты могут быть сера, сероводород, сульфиды металлов. Я рассмотрю производство серной кислоты контактным способом, при котором исходным сырьём является железный колчедан FeS 2
Принципиальная схема получения серной кислоты.
Процесс состоит из трёх стадий:
|
Процессы |
||
|
1. Обжиг железного колчедана, получение оксида серы (IV ). Очистка печного газа. |
Уравнение реакции первой стадии: 4FeS 2 + 11O 2 = Fe 2 O 3 + 8SO 2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура для обжига достигает 800 0 С. Очистка печного газа Из печи выходит печной газ, состав которого: SO 2 , O 2 , пары воды и мельчайшие частицы оксида железа. Такой печной газ необходимо очистить от примесей. Очистку печного газа проводят в два этапа - в циклоне (используется центробежная сила, твёрдые частички ссыпаются вниз) и в эл ек трофильтрах (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). Осушку печного газа проводят в сушильной башне - снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. |
|
|
2. Окисление SO 2 в SO 3 кислородом. Протекает в контактном аппарате. |
Уравнение реакции этой стадии: 2SO 2 + O 2 2SO 3 + Q Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым . Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO 3): a) температура : оптимальной температурой для протекания прямой реакции с максимальным образованием SO 3 является температура 400-500 0 С . Для того чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор - оксид ванадия - V 2 O 5 ; b) давление : прямая реакция протекает с уменьшением объёмов газов. Процесс проводят при повышенном давлении. Нагрев смеси SO 2 и O 2 до температуры 400-500 0 С начинается в теплообменнике. Смесь проходит между трубками теплообменника и нагревается от этих трубок. Как только смесь оксида серы и кислорода достигнет слоёв катализатора, начинается процесс окисления SO 2 в SO 3 . Образовавшийся оксид серы SO 3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
|
|
3. Получение H 2 SO 4 . Протекает в поглотительной башне. |
Если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H 2 SO 4 * nSO 3 . Уравнение реакции этого процесса: nSO 3 + H 2 SO 4 = H 2 SO 4 * nSO 3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожный состав и отправляют потребителю. |
Химические свойства:
H 2 SO 4 - сильная двухосновная кислота.
1) Диссоциация: по первой ступени полная диссоциация, по второй - серная кислота ведёт себя как кислота средней силы:
H 2 SO 4 H + + HSO4 - (a = 1)
HSO4 - H + + SO4 - (a 1)
2) Взаимодействие с Me:
a) Разбавленная серная кислота:
· Образует соответствующие соли с Me, стоящими в ряду напряжений левее водорода (кроме Pb):
H 2 SO 4 + Fe = FeSO 4 + H 2
· Вытесняет летучие кислоты из их солей:
H 2 SO 4 + 2NaCl = Na 2 SO 4 + 2HCl
· Вытесняет более слабые кислоты из их солей:
H 2 SO 4 + Na 2 CO 3 = Na 2 SO 4 + CO 2 + H 2 O
· Взаимодействует с основными и амфотерными оксидами:
H 2 SO 4 + CaO = CaSO 4 + H 2 O
· Взаимодействует с основаниями:
При нейтрализации гидроксида натрия серной кислотой возможно образование средней и кислой соли в зависимости от соотношения реагентов.
При избытке щелочи образуется средняя соль:
2NaOH (изб) + H 2 SO 4 = Na 2 SO 4 + 2H 2 O
Полное ионное уравнение:
2Na + + 2OH - + 2H + + SO 4 2- = 2Nа + + SO 4 2- + 2H 2 O
При избытке кислоты образуется кислая соль:
NaOH + H 2 SO 4 (изб) = NaHSO 4 + 2H 2 O
Полное ионное уравнение:
Na + + OH - + H + + HSO 4 - = Nа + + HSO 4 - + 2H 2 O
При реакции гидроксида алюминия с серной кислотой возможно образование средней и основной солей, так как Al(OH)3 - слабое основание, а H 2 SO 4 - сильная кислота. Это зависит от соотношения компонентов.
При избытке серной кислоты образуется средняя соль:
2Al(OH) 3 + 3H 2 SO 4 (изб) = Al 2 (SO 4) 3 + 6H 2 O
Полное ионное уравнение:
2Al(OH) 3 + 6H + + 3SO 4 2- = 2Al +3 + 3SO 4 2- + 6H 2 O
При соотношении 1 моль Al(OH)3 на 1 моль H 2 SO 4 получается одноосновная соль:
Al(OH) 3 + H 2 SO 4 = Al(OH)SO 4 + 2H 2 O
Полное ионное уравнение:
Al(OH) 3 + 2H + + SO 4 2- = Al(OH) 2+ + SO 4 2- + 2H 2 O
При соотношении 2 моль Al(OH)3 на 1 моль H 2 SO 4 получается двухосновная соль:
2Al(OH) 3 + H 2 SO 4 = 2 SO 4 + 2H 2 O
Полное ионное уравнение:
2Al(OH) 3 + 2H + + SO 4 2- = 2 + + SO 4 2- + 2H 2 O
b) Концентрированная серная кислота - сильный окислитель: при взаимодействии с:
· Неактивными Me - восстанавливается до SO 2:
2Ag + 2H 2 SO 4 = Ag 2 SO 4 + SO 2 + H 2 O
· Щелочноземельными Ме и магнием - до S:
3Mg + 4H 2 SO 4 = 3MgSO 4 + S + 4H 2 O
· Щелочными Ме и цинком - до H 2 S:
8Na + 5H 2 SO 4 = 4Na 2 SO 4 + H 2 S + 4H 2 O
Al, Fe и Cr пассивируются (становятся неактивными благодаря образованию защитной плёнки) концентрированной серной кислотой на холоде (поэтому H 2 SO 4 с концентрацией выше 75% перевозят в железной таре), однако при нагревании окисляются ей же с образованием сульфатов этих металлов.
Окислительная сила разбавленной и концентрированной кислот различна:
a) В реакциях с разбавленной серной кислоты с металлами Ме является восстановителем, а кислота (точнее, водород) - окислителем:
Mg + H 2 SO 4 (разб) = MgSO 4 + H 2
b) В реакциях с концентрированной серной кислоты с металлами Ме является восстановителем, а кислота (точнее, сера) - окислителем:
Mg + 2H 2 SO 4 (конц) = MgSO 4 + SO 2 + 2H 2 O
3) Взаимодействие с НеМе: окисляет неметалл до кислоты в высшей степени окисления или до оксида (если кислота неустойчива), сама восстанавливается до SO 2:
C + 2H 2 SO 4 (конц) = CO 2 + 2SO 2 + 2H 2 O
S + 2H 2 SO 4 (конц) = 3SO 2 + 2H 2 O
2P + 5H 2 SO 4 (конц) = 5SO 2 + 2H 3 PO 4 + 2H 2 O
4) Концентрированная серная кислота окисляет многие сложные вещества:
2KBr + 2H 2 SO 4 (конц) = SO 2 + Br 2 + K 2 SO 4 + 2H 2 O
8KI + 5H 2 SO 4 (конц) = H 2 S + 4I 2 + 4K 2 SO 4 + 4H 2 O
H 2 S + H 2 SO 4 (конц) = SO 2 + S + H 2 O
5) Взаимодействие с основаниями и амфотерными гидроксидами:
H 2 SO 4 + 2NaOH (изб) = Na 2 SO 4 + 2H 2 O
H 2 SO 4 (конц) + NaOH = NaHSO 4 + 2H 2 O
H 2 SO 4 + Zn(OH) 2 = ZnSO 4 + 2H 2 O
6) Взаимодействие с основными и амфотерными оксидами:
CuO + H 2 SO 4 = CuSO 4 + H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2 O
7) Вступает в обменные реакции со средними, кислыми и основными солями, если образуется газ, осадок или малодиссоциирующее вещество:
CaCO 3 + H 2 SO 4 = CaSO 4 + CO 2 + H 2 O
NaHCO 3 + H 2 SO 4 = Na 2 SO 4 + CO 2 + H 2 O
(CuOH) 2 CO 3 + 2H 2 SO 4 = 2CuSO 4 + CO 2 + 3H 2 O
8) Может превращать средние соли в кислые (или кислые в более кислые):
CaSO 4 + H 2 SO 4 = Ca(HSO 4) 2
CaHPO 4 + H 2 SO 4 = Ca(H 2 PO 4) 2 + CaSO 4
9) 100%-ная серная кислота обугливает органические вещества:
C 12 H 22 O 11(тв) + H 2 SO 4 = 12C (тв) + H 2 SO 4 *11H 2 O
10) Качественная реакция на сульфаты и серную кислоту:
BaCl 2 + H 2 SO 4 = BaSO 4 + 2HCL
(образование белого нерастворимого в кислотах осадка сульфата бария)
3. Селен
Селен - химический элемент 16-й группы, 4-го периода в периодической системе, имеет атомный номер 34, обозначается символом Se (лат. Selenium).
Атом
Порядковый № 34, электронное строение: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 .
Валентность
Степени окисления
Электроотрицательность
Физические свойства
Хрупкий блестящий на изломе неметалл чёрного цвета
Аллотропные модификации
Твёрдый селен имеет несколько аллотропных модификаций:
1) Серый селен (г-Se, «металлический селен») -- наиболее устойчивая модификация с гексагональной кристаллической решёткой
2) Красный кристаллический селен -- три моноклинные модификации: оранжево-красный б-Se, тёмно-красный в-Se, красный г-Se
3) Красный аморфный селен
4) Чёрный стекловидный селен
При нагревании серого селена он даёт серый же расплав, а при дальнейшем нагревании испаряется с образованием коричневых паров. При резком охлаждении паров селен конденсируется в виде красной аллотропной модификации.
Нахождение в природе
Содержание селена в земной коре -- около 500 мг/т. Основные черты геохимии селена в земной коре определяются близостью его ионного радиуса к ионному радиусу серы. Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены ашавалит FeSe, клаусталит PbSe, тиманнит HgSe, гуанахуатит Bi 2 (Se, S) 3 , хастит CoSe 2 , платинит PbBi 2 (S, Se) 3 , ассоциирующие с различными сульфидами. Изредка встречается самородный селен
Получение селена
Значительные количества селена получают из шлама медно-электролитных производств, в котором селен присутствует в виде селенида серебра. Применяют несколько способов получения:
1) окислительный обжиг с возгонкой SeO 2 ;
2) нагревание шлама с концентрированной серной кислотой, окисление соединений селена до SeO 2 с его последующей возгонкой;
3) окислительное спекание с содой, конверсия полученной смеси соединений селена до соединений Se(IV) и их восстановление до элементарного селена действием SO 2 .
Химические свойства
Селен -- аналог серы и проявляет степени окисления?2 (H 2 Se), +4 (SeO 2) и +6 (H 2 SeO 4). Однако, в отличие от серы, соединения селена в степени окисления +6 -- сильнейшие окислители, а соединения селена (-2) -- гораздо более сильные восстановители, чем соответствующие соединения серы.
Простое вещество селен гораздо менее активно химически, чем сера. Так, в отличие от серы, селен не способен гореть на воздухе самостоятельно. Окислить селен удаётся только при дополнительном нагревании, при котором он медленно горит синим пламенем, превращаясь в двуокись SeO 2 . Со щелочными металлами селен реагирует (весьма бурно), только будучи расплавленным.
В отличие от SO 2 , SeO 2 -- не газ, а кристаллическое вещество, хорошо растворимое в воде. Получить селенистую кислоту (SeO 2 + H 2 O > H 2 SeO 3) ничуть не сложнее, чем сернистую. А действуя на неё сильным окислителем (например, HClO 3), получают селеновую кислоту H 2 SeO 4 , почти такую же сильную, как и серная.
Применение
Одним из важнейших направлений его технологии, добычи и потребления являются полупроводниковые свойства как самого селена, так и его многочисленных соединений (селенидов), их сплавов с другими элементами, в которых селен стал играть ключевую роль.
Стабильный изотоп селен-74 позволил на своей основе создать плазменный лазер с колоссальным усилением в ультрафиолетовой области (около миллиарда раз).
Радиоактивный изотоп селен-75 используется в качестве мощного источника гамма-излучения для дефектоскопии.
Селенид калия совместно с V 2 O 5 применяется при термохимическом получении водорода и кислорода из воды (селеновый цикл)
4. Теллур
Теллур -- химический элемент 16-й группы, 5-го периода в периодической системе, имеет атомный номер 52; обозначается символом Te (лат. Tellurium ) .
Атом
Порядковый № 52, электронное строение: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 4 .
Валентность
Степени окисления
Электроотрицательность
Нахождение в природе
Физические свойства
Теллур -- хрупкое серебристо-белое вещество с металлическим блеском. В тонких слоях на просвете красно-коричневый, в парах -- золотисто-жёлтый. При нагревании приобретает пластичность. Кристаллическая решётка -- гексагональная.
Получение теллура
Основной источник -- шламы электролитического рафинирования меди и свинца. Шламы подвергают обжигу, теллур остается в огарке, который промывают соляной кислотой. Из полученного солянокислого раствора теллур выделяют, пропуская через него сернистый газ SO 2 .
Для разделения селена и теллура добавляют серную кислоту. При этом выпадает диоксид теллура ТеО 2 , а H 2 SeO 3 остается в растворе.
Из оксида ТеО 2 теллур восстанавливают углем.
Для очистки теллура от серы и селена используют его способность под действием восстановителя (Al, Zn) в щелочной среде переходить в растворимый дителлурид динатрия Na 2 Te 2:
6Te + 2Al + 8NaOH = 3Na 2 Te 2 + 2Na
Для осаждения теллура через раствор пропускают воздух или кислород:
3Na 2 Te 2 + 2H 2 O + O 2 = 4Te + 4NaOH
Для получения теллура особой чистоты его хлорируют:
Te + 2Cl2 = TeCl 4
Образующийся тетрахлорид очищают дистилляцией или ректификацией. Затем тетрахлорид гидролизуют водой:
TeCl 4 + 2H 2 O = TeO 2 + 4HCl
а образовавшийся ТеО 2 восстанавливают водородом:
TeO 2 + H 2 = Te + 2H 2 O
Химические свойства
В химических соединениях теллур проявляет степени окисления -2; +2; +4; +6. Является аналогом серы и селена, но химически менее активен, чем сера. Растворяется в щелочах, поддается действию азотной и серной кислот, но в разбавленной соляной кислоте растворяется слабо. С водой металлический теллур начинает реагировать при 100 0 C.
С кислородом образует соединения TeO, TeO 2 , TeO 3 . В виде порошка окисляется на воздухе даже при комнатной температуре, образуя оксид TeO 2 . При нагреве на воздухе сгорает, образуя TeO 2 -- прочное соединение, обладающее меньшей летучестью, чем сам теллур. Это свойство используется для очистки теллура от оксидов, которые восстанавливают проточным водородом при температуре 500--600°C. Диоксид теллура плохо растворим в воде, хорошо -- в кислых и щелочных растворах.
В расплавленном состоянии теллур довольно инертен, поэтому в качестве контейнерных материалов при его плавке применяют графит и кварц.
Теллур образует соединение с водородом при нагревании, легко реагирует с галогенами, взаимодействует с серой и фосфором и металлами. При взаимодействии с концентрированной серной кислотой образует сульфит. Образует слабые кислоты: теллурводородную (H 2 Te), теллуристую (H 2 TeO 3) и теллуровую (H 6 TeO 6), большинство солей которых плохо растворимы в воде.
Применение
Теллур используют при производстве сплавов, термоэлектрических материалов, халькогенидных стёкол, в производстве резины.
5. Полоний
Полоний - радиоактивный химический элемент 16-й группы, 6-го периода в периодической системе Д.И. Менделеева, с атомным номером 84, обозначается символом Po (лат. Polonium)
Атом
Порядковый № 84, электронное строение:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 5d 10 4f 14 6p 4 .
Валентность
Степени окисления
Электроотрицательность
Физические свойства
При нормальных условиях представляет собой мягкий металл серебристо-белого цвета.
Изотопы
Известны 33 изотопа полония в диапазоне массовых чисел от 188 до 220. Кроме того, известны 10 метастабильных возбуждённых состояний изотопов полония. Стабильных изотопов не имеет. Наиболее долгоживущие изотопы 209 Po и 208 Po.
Получение
На практике в граммовых количествах нуклид полония 210 Ро синтезируют искусственно, облучая металлический 209 Bi тепловыми нейтронами в ядерных реакторах. Получившийся 210 Bi за счёт в-распада превращается в 210 Po. При облучении того же изотопа висмута протонами по реакции
209 Bi + p > 209 Po + n
образуется самый долгоживущий изотоп полония 209 Po.
Химические свойства
Металлический полоний быстро окисляется на воздухе. Известны диоксид полония (РоО 2) x и монооксид полония РоО. С галогенами образует тетрагалогениды. При действии кислот переходит в раствор с образованием катионов Ро 2+ розового цвета:
Po + 2HCl = PoCl 2 + H 2
При растворении полония в соляной кислоте в присутствии магния образуется полоноводород:
Po + Mg + 2HCl = MgCl 2 + H 2 Po
который при комнатной температуре находится в жидком состоянии (от?36,1 до 35,3 °C)
В индикаторных количествах получены кислотный триоксид полония РоО 3 и соли полониевой кислоты, не существующей в свободном состоянии -- полонаты К 2 РоО 4 . Образует галогениды состава PoX 2 , PoX 4 и PoX 6 . Подобно теллуру полоний способен с рядом металлов образовывать химические соединения -- полониды.
Полоний является единственным химическим элементом, который при низкой температуре образует одноатомную простую кубическую кристаллическую решётку
Применение
Полоний-210 в сплавах с бериллием и бором применяется для изготовления компактных и очень мощных нейтронных источников, практически не создающих г-излучения.
Полоний-210 часто применяется для ионизации газов (в частности, воздуха).
Важной областью применения полония-210 является его использование в виде сплавов со свинцом, иттрием или самостоятельно для производства мощных и весьма компактных источников тепла для автономных установок, например, космических.
Полоний-210 может послужить в сплаве с лёгким изотопом лития (6 Li) веществом, которое способно существенно снизить критическую массу ядерного заряда и послужить своего рода ядерным детонатором
6. Ливерморий
Ливермомрий (лат. Livermorium, Lv), ранее был известен как унунгемксий (лат. Ununhexium, Uuh) и эка-полоний -- 116-й химический элемент, относится к 16-й группе и 7-му периоду периодической системы, атомный номер -- 116, атомная масса наиболее устойчивого изотопа -- 293. Искусственно синтезированный радиоактивный элемент, в природе не встречается.
Атом
Порядковый № 116, электронное строение:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 5d 10 4f 14 6p 6 7s 2 6d 10 5f 14 7p 4 .
Валентность
Изотопы
Получение
Изотопы ливермория были получены в результате ядерных реакций:
а также в результате б-распада 294 Uuo:
Химические свойства
Ливерморий является представителем группы халькогенов, где он следует после полония. Однако химические свойства ливермория будут существенно отличаться от свойств полония, поэтому разделить эти элементы не составит труда.
Предполагается, что основной и наиболее устойчивой степенью окисления для ливермория будет +2. Ливерморий будет образовывать оксид ливермория с кислородом (LvO), галогениды LvHal 2 .
Со фтором или в более жёстких условиях ливерморий также сможет проявлять степень окисления +4 (LvF 4). Такую степень окисления ливерморий может проявлять как в катионах, так и образовывать, подобно полонию, ливерморовую кислоту или её соли -- ливермориты (или ливермораты), например K 2 LvO 3 -- например, ливерморит калия.
Ливермориты, а также другие соединения ливермория со степенью окисления +4 будут проявлять сильные окислительные свойства, подобные перманганатам. В отличие от более лёгких элементов, предполагается, что степень окисления +6 для ливермория будет, вероятно, невозможна из-за крайне высокой необходимой энергии на распаривание 7s 2 электронной оболочки, поэтому высшая степень окисления ливермория будет равна +4.
С сильными восстановителями (щелочные металлы или щелочноземельные металлы) возможна также степень окисления?2 (например, соединение CaLv будет называться ливерморидом кальция). Однако ливермориды будут очень неустойчивыми, и проявлять сильные восстановительные свойства, поскольку образование аниона Lv 2- и включение двух дополнительных электронов невыгодно основной оболочке 7p-электронов, а предполагаемая химия ливермория делает намного выгоднее образование катионов, чем анионов.
С водородом предполагается образование гидрида H 2 Lv, который будет называться ливермороводородом. Для ливермороводорода ожидаются весьма интересные свойства, например, предполагается возможность «сверхгибридизации» -- невовлечённые 7s 2 электронные облака ливермория смогут образовать дополнительную взаимную связь между собой, и такая связь будет несколько напоминать водородную связь, поэтому свойства ливермороводорода могут отличаться от свойств халькогеноводородов более лёгких аналогов. Ливермороводород, несмотря на то, что ливерморий будет однозначно металлом, не будет повторять свойств гидридов металлов в полной мере и будет сохранять в значительной степени ковалентный характер.
Подобные документы
Общая характеристика химических элементов IV группы таблицы Менделеева, их нахождение в природе и соединения с другими неметаллами. Получение германия, олова и свинца. Физико-химические свойства металлов подгруппы титана. Сферы применения циркония.
презентация , добавлен 23.04.2014
Общая характеристика элементов І группы, их химические и физические свойства, история открытия и особенности способов получения. Литий и его соединения. Закономерности в строении атомов щелочных металлов. Правила хранения некоторых элементов этой группы.
презентация , добавлен 30.11.2012
Характеристика азота – элемента 15-й группы второго периода периодической системы химических элементов Д. Менделеева. Особенности получения и применения азота. Физические и химические свойства элемента. Применение азота, его значение в жизни человека.
презентация , добавлен 26.12.2011
Знакомство с основными химическими элементами, представленными в периодической системе Д. Менделеева. Рассмотрение классификации биогенных элементов. Микроэлементы как биологически активные атомы центров ферментов. Характеристика свойств s-элементов.
презентация , добавлен 00.00.0000
Открытие периодического закона и разработка периодической системы химических элементов Д.И. Менделеевым. Поиск функциональных соответствий между индивидуальными свойствами элементов и их атомными весами. Периоды, группы, подгруппы Периодической системы.
реферат , добавлен 21.11.2009
Основные классы неорганических соединений. Распространенность химических элементов. Общие закономерности химии s-элементов I, II и III групп периодической системы Д.И. Менделеева: физические, химические свойства, способы получения, биологическая роль.
учебное пособие , добавлен 03.02.2011
История открытия и место в периодической системе химических элементов Д.И. Менделеева галогенов: фтора, хлора, брома, йода и астата. Химические и физические свойства элементов, их применение. Распространённость элементов и получение простых веществ.
презентация , добавлен 13.03.2014
Изучение понятия и основных свойств галогенов - химических элементов (фтор, хлор, бром, йод и астат), составляющих главную подгруппу VII группы периодической системы Д.И. Менделеева. Положительное и отрицательное влияние галогенов на организм человека.
презентация , добавлен 20.10.2011
Физические и химические свойства галогенов, их положение в Периодической таблице элементов Менделеева. Основные источники и биологическое значение хлора, брома, иода, фтора. Нахождение галогенов в природе, их получение и промышленное использование.
презентация , добавлен 01.12.2014
Металлы. Методы получения металлов. Химические свойства металлов. Характеристика металлов главной подгруппы I группы. Характеристика элементов главной подгруппы II группы. Характеристика элементов главной подгруппы III группы. Алюминий. Переходные металлы
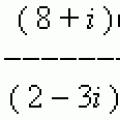 Действия над комплексными числами в алгебраической форме
Действия над комплексными числами в алгебраической форме Движение материальной точки по окружности
Движение материальной точки по окружности Сечение поверхности конуса плоскостью общего положения
Сечение поверхности конуса плоскостью общего положения