Пути фиксации СО2 при фотосинтезе. С4-путь фотосинтеза (цикл хетча и слэка) Акцептором со2 у растений с4 является
Фотосинтез – это процесс трансформации поглощенной растением энергии солнечного света в химическую энергию органических соединений. С 4 - путь фотосинтеза или цикл Хетча-Слэка.
Австралийскими учеными Хетчем и Слэком был описан С 4 -путь фотосинтеза, характерный для тропических и субтропических растений (сахарный тростник, кукуруза и др.). Листья этих растений содержат хлоропласты двух типов: обычные в клетках мезофилла и крупные хлоропласты, не имеющие гран и фотосистемы II, в клетках обкладки, окружающих проводящие пучки.
В цитоплазме клеток мезофилла присоединяет СО 2 к пировиноградной кислоте, образуя щавелевоуксусную кислоту. Она транспортируется в хлоропласты, где восстанавливается до яблочной кислоты при участии НАДФН. В присутствии ионов аммония щавелевоуксусная кислота превращается в аспарагиновую кислоту. Яблочная и (или) аспарагиновая кислоты переходят в хлоропласты клеток обкладки, восстанавливаются до пировиноградной кислоты и СО 2 . СО 2 включается в цикл Кальвина, а пировиноградная кислота переносится в клетки мезофилла, где превращается в пировиноградную кислоту. Такой механизм позволяет растениям фотосинтезировать при закрытых из-за высокой температуры устьицах. Кроме того, продукты цикла Кальвина образуются в хлоропластах клеток обкладки, окружающих проводящие пучки. Это способствует быстрому оттоку фотоассимилятов и тем самым повышает интенсивность фотосинтеза.
Липиды: классификация и их роль в растении.
Липиды представляют собой достаточно сложные по химической структуре вещества. В их состав также входят углерод, кислород, водород, но в отдельные группы липидов могут входить и фосфор, и сера, и азот (фосфатиды, пигменты). Все липиды гидрофобны, т.е. не растворяются в воде. Функции у липидов различны в зависимости от химического строения. Липиды не являются биополимерами.
Липиды классифицируются на 5 больших групп по признаку функции и сложности строения:Жиры- наиболее легко синтезируемая группа липидов. С химической точки зрения - это эфиры жирных кислот и глицерина.Основные функции жиров - энергетическая, строительная и запасающая.Воска - это жироподобные вещества, твердые при комнатной температуре. По химической структуре - это сложные эфиры между жирными кислотами и высокомолекулярными одноатомными спиртами жирного ряда.Основная функция восков - защитная.Фосфатиды - к которым относятся глицерофосфатиды, лецитины и кефалины - это молекулы сложных эфиров глицерина, жирных кислот и фосфорной кислоты. Эти вещества входят в состав запасных жиров и предохраняют их от прогоркания.Основная функция фосфатидов - запасающая.
Пигменты (хлорофиллы и каротиноиды) - это особая группа липидов, имеющая сложное строение, куда входят и азотистые радикалы. К пигментам относят две группы веществ - хлорофиллы и каротиноиды.
Основная функция пигментов - участие в энергетической (световой) фазе фотосинтеза.Стероиды - это производные сложного гетероциклического соединения. В эту группу соединений входят высокомолекулярные спирты (стеролы) и их сложные эфиры (стериды) Наиболее известный стероид - эргостерол, из которого в промышленности получают витамин Д.
Основная функция стероидов- строительная (участвуют в составе мембран).
С4-растения (С4 plants) - растения, у которых третий этап фотосинтеза протекает с присоединением углекислого газа не к рибулозодифосфату (как у С3-растений), а к трехуглеродному соединению - фосфоенолпировиноградной кислоте, что приводит к образованию четырехуглеродного (С4) соединения - щавелево-уксусной кислоты. К этому типу относятся такие растения, как кукуруза и некоторые другие злаки, преимущественно тропических и субтропических растений (сахарный тростник, сорго)
С3-растения (C3 plants) [англ. c(arbon) - углерод, от лат. carbo - уголь] - растения, у которых третий этап фотосинтеза протекает с участием цикла Кальвина (восстановительный пентозофосфатный цикл, при котором первым продуктом является трехуглеродное (С3) соединение - фосфоглицериновая кислота). К этому типу относится большинство растений.
Физиолого-биохимичсекие различия между С3- и С4-растениями.
У большинства растений первым продуктом фотосинтеза является фосфоглицериновая кислота, содержащая 3 атома водорода. Такие растения называются С3-растениями. Однако уже давно было обнаружено, что у некоторых растений первым продуктом фотосинтеза являются органические кислоты не с тремя, а с четырьмя атомами углерода – щавелевоуксусная и яблочная (малат). Такие растения называются С4-растениями, к ним относятся многие тропические и субтропические растения, в т.ч. некоторые важные культурные виды – сахарный тростник, просо, сорго и кукуруза.
С4-растения имеют характерную особенность в строении листа: у них проводящие пучки окружены 2 кольцами клеток – внешним и внутренним. Внешнее кольцо состоит из обычных клеток мезофилла, а внутреннее – из 222b14hc специализированных клеток, которые называются клетками обкладки проводящего пучка. Клетки обкладки похожи на клетки мезофилла, но отличаются от них строением хлоропластов: в их хлоропластах очень слабо развита система внутренних мембран и содержится очень мало хлорофилла, поэтому хлоропласты клеток обкладки бледно-зеленые. Такое строение листа у С4-растений называется кранц-анатомией («кранц» в переводе означает корона или ореол).
Биохимические различия между С4- и С3-растениями.
Внешние различия между С3- и С4-растениями обусловлены тем, что у них фотосинтез идет по-разному. У С3-растений в одном и том же хлоропласте фиксируется СО 2 , образуется водород и АТФ, а затем в ходе темновой фазы эти вещества используются для синтеза органических веществ. У С4-растений эти процессы разделены в пространстве: АТФ, водород и СО 2 накапливаются в хлоропластах клеток мезофилла, а оттуда транспортируются в хлоропласты клеток проводящего пучка, где из них синтезируются органические вещества. Такой транспорт называется путем Хетча-Слека. У С4-растений между световой и темновой фазами происходит еще 3 стадии фотосинтеза.
13.Методы учета фотосинтеза: качественные и количественные.
Опишем в самых кратких чертах методы определения фотосинтеза. Эти методы могут быть разбиты на две категории:
1.методы, связанные с учетом органических продуктов фотосинтеза;
2.газометрические методы, учитывающие выделение кислорода или поглощение углекислоты.
Как первые, так и вторые могут быть качественного, сравнительного и количественного характера. Из качественных методов мы уже знаем крахмальную пробу. Ее можно произвести не только микроскопически, но и макроскопически. Для этого берут обескрахмаленный лист и выставляют его на свет, закрывши часть листа темной бумагой или станиолью. В тех местах, которые не были закрыты бумагой, образуется крахмал. Последнее легко доказать, обесцвечивая лист спиртом и действуя на него раствором йода в йодистом калии.
Работа по методу половинок возможна только с крупными и симметричными листьями. От листа вдоль по средней жилке срезается половинка. Из нее шаблоном вырезается определенная площадь и высушивается до сухого веса при 105 °C. Вторая половинка листа оставляется на растении на свету в течение нескольких часов. После этого с нею поступают так же, как и с первой. Кроме того, в опыте должен быть и второй лист, у которого оставляется на несколько часов закрытая темной бумагой половинка для учета оттока углеводов из листа и его дыхания. Привес взятой половинки первого листа с прибавленной к нему убылью второй и даст нам величину фотосинтеза. Ее обычно вычисляют на 1 дм2 площади листа за один час.
Из методов, основанных на изучении другой стороны фотосинтеза, а именно учитывающих газообмен, следует отметить качественный метод учета выделившегося кислорода. Водное растение, например элодея, выставляется на свет, и выделяющийся кислород собирается в наполненную водой пробирку (рис. 102). Когда кислорода собирается достаточное количество, вынимают пробирку и вносят в нее тлеющую лучинку. Лучинка вспыхивает.
Сравнительный метод счета пузырьков также проводится с водным растением элодеей. Для этого устанавливают ветку элодеи в пробирке таким образом, чтобы ее конус нарастания был обращен вниз, а срез стебля вверх. Из среза стебля выделяются пузырьки кислорода, число которых и подсчитывается за одну минуту. Используя этот метод, можно выяснить относительную интенсивность процесса фотосинтеза в зависимости от температуры и качества света.
Количественные газометрические методы по учету фотосинтеза многообразны. Остановимся лишь на одном, который дает возможность изучать процесс в естественной обстановке (рис. 103). Не отрывая от растения лист, его заключают в стеклянную камеру, сквозь которую просасывается воздух при помощи аспиратора. Воздух с оставшейся после фотосинтеза углекислотой проходит через специальную трубку с налитым в нее раствором барита (едкий барий), поглощающим оставшуюся углекислоту воздуха. Перед входом в трубку небольшой продырявленной пластинкой воздух разбивается на мелкие пузырьки, которые, проходя через раствор барита, отдают раствору находящуюся в них углекислоту. После окончания опыта раствор барита титруют кислотой. Чем больше поглотилось углекислого газа зеленым листом, тем больше кислоты пойдет на титрование, так как при этом будет образовываться меньшее количество углекислого бария. Параллельно ставится вторая трубка, через которую пропускается воздух, чтобы определить в нем содержание углекислоты и выяснить количество углекислоты, поглощенной зеленым листом. Метод этот хорош тем, что дает возможность определить фотосинтез в природной обстановке при нормальном содержании углекислоты в воздухе. Недостатком его являются искусственные условия в камере, приводящие нередко к перегреву листа. При перегреве нормальный ход фотосинтеза изменяется, так как интенсивность процесса при этом сильно падает.
Существует большая группа растений (500 видов покрытосеменных), у которых первичными продуктами фиксации СО 2 и восстановления являются четырехуглеродные соединения. Их называют С 4 -растениями . Основы для биохимического исследования фотосинтеза у _С 4 -растений были заложены в работах Л. А. Незговоровой (1956-1957), К. С. Карпилова и И. А. Тарчевского (1960-1963). В 1966 г. Хетч и Слэк (австрал.) предложили законченную схему цикла темповых реакций у С 4 -растений, которая получила название цикла Хетча и Слэка .
К С 4 -растениям относится ряд культурных растений преимуественно тропического и субтропического происхождения: кукуруза, просо, сорго, сахарный тростник и многие злостные сорняки - свинорой, сыть округлая, ежовник крестьянский, просо куриное, просо крупное, гумай (сорго алепское), щирица, щетинник и др . Как правило, это высокопродуктивные растения, устойчиво осуществляющие фотосинтез при значительных повышениях температуры и в засушливых условиях .
Для листьев С 4 -растений характерно анатомическое строение кранц-типа (от нем. Kranz - венок, корона ), т. е. наличие явно отличающихся друг от друга фотосинтезирующих клеток двух типов, которые располагаются концентрическими кругами: радиально расположенные вокруг проводящих пучков клетки обкладки и основной мезофилл (рис. 40).
Клетки обкладки проводящего пучка содержат крупные, лишенные гран (агранальные ) хлоропласты . В клетках мезофилла находятся более мелкие гранальные хлоропласты . Эти два типа клеток физиологически не равноценны и специализируются на выполнении разных звеньев фотосинтеза.
C 4 -цикл можно разделить на две стадии : карбоксилирование (в клетках мезофилла ) и декарбоксилирование и синтез углеводов (в клетках обкладки проводящих пучков ). Общим для всех С 4 -растений является то, что карбоксилированию подвергается фосфоенолпировиноградная кислота (ФЕП ) при участии ФЕП-карбоксилазы и образуется щавелевоуксусная кислота (ЩУК ), которая восстанавливается до яблочной кислоты или аминируется с образованием аспарагиновой кислоты .
ЩУК, яблочкая и аспарагиновая кислоты являются C 4 соединениями .
По способу декарбоксилирования при участии НАДФ-Н или НАД-малатдегидрогеназы (МДГ), называемой также малик-энзимом и яблочным ферментом) или ФЭП-карбоксикиназы (ФЕП-КК) у С 4 -растений можно выделить три группы : НАДФ-МДГ, НАД-МДГ и ФЕП-КК-типы соответственно.
У НАДФ-МДГ-растений главными метаболитами, вовлеченными в обмен между клетками, являются малат и пируват (ПВК) , у НАД-МДГ-растений - аспартат и аланин и у ФЕП-КК-растений - аспартат и ФЕП .
Важнейшие с-х культуры (кукуруза, сорго, сахарный тростник) и такие сорняки, как сыть, ежовник, щетинник, гумай относятся к НАДФ-МДГ-типу.
Рассмотрим С 4 -цикл восстановления СО 2 на примере этих растений (рис .).
СО 2 , поступающий в лист через устьица, попадает в цитоплазму клеток мезофилла , где при участии ФЕП-карбоксилазы вступает в реакцию с ФЕП , образуя ЩУК (оксалоацетат).
Затем в хлоропластах ЩУК восстанавливается до яблочной кислоты (малата) за счет НАДФ Н , образующегося в ходе световой фазы фотосинтеза; ЩУК в присутствии NH 4 может превращаться также в аспартат .
Опыты с радиоактивной меткой ( 14 С) показали, что после освещения растений в течение 1 с более 90 % радиоактивности обнаруживается в составе С 4 -кислот.
Затем малат переносится в хлоропласты клеток обкладки сосудистого пучка, где он подвергается окислительному декарбоксилированию , продуктом которого является ПВК . Последняя снова диффундирует в мезофилл , где при участии АТФ, образованной в световой фазе, происходит регенерация ФЕП , после чего цикл карбоксилирования повторяется с участием новой молекулы СО 2 . Образовавшиеся в результате окислительного декарбоксилирования малата СО 2 и НАДФ-Н поступают в цикл Кальвина , что приводит к образованию ФГК и других продуктов , свойственных С 3 -растениям. Следовательно, именно клетки обкладки выполняют роль основной ассимилирующей ткани, поставляющей сахара в проводящую систему. Клетки мезофилла выполняют вспомогательную функцию - подкачку СО 2 для цикла Кальвина.
Таким образом, С 4 -путь обеспечивает более полное усвоение СО 2 , что особенно важно для тропических растений, где основным лимитирующим фактором фотосинтеза является концентрация СО 2 . Эффективность усвоения СО 2 С 4 -растениями увеличивается также за счет подачи НАДФ-Н в хлоропласты клеток обкладки . Эти хлоропласты имеют агранальное строение и специализируются на темповой фазе фотосинтеза, здесь практически не происходит НЦФФ. На один агранальный хлоропласт в среднем приходится 8-10 гранальных хлоропластов, осуществляющих первичную фиксацию СО 2 и НЦФФ. Такая компартментация процессов и кооперация функционирования тканей обеспечивают повышение продуктивности растений и позволяют накапливать СО 2 в органических кислотах для осуществления фотосинтеза даже при закрытых устьицах в наиболее жаркое время дня . Это сокращает потери воды на транспирацию . Эффективность использования воды С 4 -растениями вдвое выше , чем у С 3 -растений.
Путь С4 получил свое название, т.к. в темновой фазе первичным продуктом фиксации СО2 в этом случае является органическое соединение не с тремя, а с четырьмя атомами углерода (щавелевоуксусная кислота). Таким типом фотосинтеза обладают тропические растения жарких стран, например, бромелиевые. Было давно замечено, что эти растения усваивают СО2 намного лучше С3 растений. В анатомической структуре листьев С4-растений, наряду с нормальными обычными хлоропластами, вокруг сосудистых пучков у них имеются особый вид очень плотных хлоропластов почти без тилакоидов, но наполненных крахмалом. Эти хлоропласты назвали обкладочными.
В обычных хлоропластах у С4 растений, как и положено, протекает световая фаза фотосинтеза, а также происходит фиксация СО2 , но при этом образуется щавелевоуксусная кислота. Такая щавелевоуксусная кислота превращается в яблочную, которая поступает в обкладочные хлоропласты, где сразу расщепляется с выделением СО2. А дальше все идет, как и у нормальных С3 растений. При этом концентрация СО2 в обкладочных хлоропластах в результате становится значительно выше, чем у С3 растений, а очень плотное расположение этих хлоропластов обеспечивает то, что кислорода к ним почти не поступает, межклетников-то нет. Поэтому, раз нет кислорода, а углекислого газа сколько хочешь, фотодыхание не наступает.
Таким образом, у С4 растений и фиксация СО2 происходит более эффективно в виде других соединений, и образование сахаров осуществляется в особых хлоропластах, в результате чего сокращается интенсивность фотодыхания и связанных с ним потерь.
С4 растения могут захлопнуть свои устьица в жару, и не терять такой драгоценной влаги. У них обычно накоплено достаточно СО2 в виде яблочной кислоты.
27. Фотодыхание: биохимические реакции, их локализация. Физиологическая роль фотодыхания.
Фотодыхание – это активируемый светом процесс выделения СО2 и поглощения О2. Первичным продуктом фотодыхания является гликолевая кислота. Фотодыхание усиливается при низком содержании СО2 и высокой концентрации О2 в воздухе. В этих условиях рибулозодисфаткарбоксилаза хлоропластов катализирует не карбоксилирование рибулозо-1,5-дифосфата, а его расщепление на 3-фосфоглицериновую и 2-фосфогликолевую кислоты. Последняя дефосфорилируется с образованием гликолевой кислоты.
Гликолевая кислота из хлоропласта переходит в пероксисому, где окисляется до глиоксиловой кислоты. Глиоксиловая кислота аминируется, превращаясь в глицин. Глицин транспортируется в митохондрию, где из двух молекул глицина синтезируется серин и освобождается СО2.
Серин может поступать в пероксисому и передает аминогруппу на пировиноградную кислоту с образованием аланина, а сам превращается в гидроксипировиноградную кислоту. Последняя при участии НАДФН восстанавливается в глицериновую кислоту. Она переходит в хлоропласты, где включается в цикл Кальвина
У растений С4 -типа выделяющийся при фотодыхании углекислый газ реагирует в клетках мезофилла с фосфоэнолпировиноградной кислотой с образованием щавелевоуксусной и яблочной кислот. Яблочная кислота переходит в клетки обкладки, где служит донором СО2. Растения С3-пути характеризуются высокой интенсивностью фотодыхания. Фосфогликолевая кислота через ряд превращений распадается с выделением С02. Таким образом, при фотодыхании часть промежуточных продуктов фотосинтеза теряется за счет выделения С02. Реакции окисления и карбоксилирования конкурируют друг с другом, а осуществление карбоксилазной или оксигеназной функции зависит от содержания 02 и С02
Фотодыхание снижает эффективность фотосинтеза, приводит к потерям ассимилированного углерода, однако имеет некоторое синтетическое значение. На ранних этапах развития жизни, когда в атмосфере было мало кислорода, рубиско заняло ключевую позицию в фотосинтезе, и ее оксигеназная функция не доставляла проблем. По мере увеличения содержания кислорода потери на фотодыхание нарастали, и у ряда растений возникли механизмы активной доставки к месту работы рубиско углекислого газа (см. C4 и CAM-фотосинтез), увеличивающее долю её карбоксилазной активности до 100%.
В 1965 г. было обнаружено, что первыми продуктами фотосинтеза у сахарного тростника (растение тропиков) являются органические кислоты, в состав которых входят 4 атома углерода (яблочная, щевелевоуксусная и аспарагиновая), а не 3С-кислота (фосфоглицериновая), как у большинства растений умеренного климата. С тех пор выявили множество растений, в основном тропических и субтропических, и имеющих порой важное экономическое значение, у которых фотосинтез протекает по такому же пути. Они получили название С4-растений. Примерами могут служить кукуруза, сорго, сахарный тростник и просо. Растения, в которых первым продуктом фотосинтеза является трехуглеродная фосфоглицериновая кислота, носят название С3-растения.
Биохимию именно С3-растений мы рассматривали до сих пор в этой главе.
В 1966 г. австралийские исследователи Хэтч и Слэк (Hatch, Slack) показали, что С4-растения значительно эффективнее, чем Сграстения, поглощают диоксид углерода: они способны удалять СО: из экспериментальной атмосферы вплоть до концентрации 0,1 части на миллион, тогда как для С 3 -растений это значение составляет 50-100 Ч*млн -1 . Хэтч и Слэк описали новый путь метаболизма углерода у Сграсгений, получивший название путь Хэтча-Слэка . Далее мы изучим этот процесс на примере типичного Сграстения - кукурузы.
У С4-растений листья имеют характерную особенность строения: вокруг каждого проводящего пучка у них расположены два ряда клеток. У клеток внутреннего кольца - обкладки проводящего пучка - хлоропласты по своей форме отличаются от хлоропластов клеток мезофилла внешнего кольца. Различие в строении хлоро-пластов у С 4 -растений получило название диморфизма (наличие двух форм). На рисeyrt, Ли Б показана так называемая «кранц-анатомия» (Kranz - корона, ореол; таким образом описываются те два ряда клеток, которые окружают проводящие пучки и имеют в сечении вид двух колец). Биохимические превращения, протекающие в этих клетках, описаны ниже; см. также рис. 7.22.
Путь Хэтча-Слэка
Путь Хэтча-Слэка предназначен для транспортировки диоксида углерода и водорода из клеток мезофилла в клетки обкладки проводящих пучков. Из клеток обкладки проводящих пучков диоксид углерода высвобождается и поступает в обычный С 3 -путь фотосинтетических превращений.
Захват (фиксация) диоксида углерода в клетках мезофилла
Диоксид углерода фиксируется в цитоплазме клеток мезофилла. Механизм этого процесса приведен в следующем уравнении:

Акцептором диоксида углерода служит фосфоенолпируват (ФЕП) вместо РиБФ у С3-растений, а вместо фермента РиБФ-карбоксилазы у С4-растений участвует фермент ФЕП-карбоксилаза. Фермент ФЕП-карбоксилаза работает значительно более эффективно, чем фермент С 3 -растений по двум причинам. Во-первых, ФЕП-карбоксилаза обладает большим сродством к диоксиду углерода, а во-вторых, ее работа не подвергается конкурентному ингибированию кислородом. Образовавшаяся щавелево-уксусная кислота далее превращается в малат, 4С-кислоту.
Малатный обходной путь (шунт)
Пройдя через плазмодесмы в клеточных стенках, малат попадает в хлоропласты клеток обкладки проводящего пучка, где он, соединяясь с диоксидом углерода, превращается в пируват (ЗС-кислоту). При этом выделяется водород, который используется для восстановления НАДФ. Обратите внимание, что в клетки мезофилла диоксид углерода и водород поступают извне, а затем в клетках обкладки проводящего пучка они вновь удаляются. Суммарным эффектом этих процессов является перемещение диоксида углерода и водорода из клеток мезофилла в клетки обкладки проводящего пучка.
Регенерация акцептора диоксида углерода
Пируват возвращается в клетки мезофилла , где в результате присоединения фосфатной группы от АТФ используется для регенерации ФЕП. На это расходуется энергия двух высокоэнергетических фосфатных связей.
- Вернуться в оглавление раздела " "
 Презентация - тире между подлежащим и сказуемым
Презентация - тире между подлежащим и сказуемым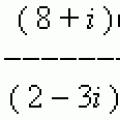 Действия над комплексными числами в алгебраической форме
Действия над комплексными числами в алгебраической форме Движение материальной точки по окружности
Движение материальной точки по окружности